
【题目】将共0.4molMg、Al的混合物用盐酸完全溶解,放出标准状况下11.2L气体,然后再滴2mol/LNaOH溶液,请回答:
(1)求该混合物中Mg、Al的物质的量之比______________
(2)若该Mg、Al的混合物与盐酸恰好完全反应,在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V=________________ mL。
(3)若该Mg、Al混合物溶于400mL 3mol/L盐酸后,滴入NaOH溶液,使所得沉淀中无Al(OH)3,则滴入NaOH溶液的体积最少为 _____________________ mL。
【答案】1:1 500 700
【解析】
(1)气体为氢气,n=![]() =0.5mol,结合电子及原子守恒计算;
=0.5mol,结合电子及原子守恒计算;
(2)该Mg、Al的混合物与盐酸恰好完全反应,在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,生成氢氧化镁、氢氧化铝,结合原子守恒计算;
(1)气体为氢气,n=![]() =0.5mol,设Mg、Al的物质的量分别为x、y,则
=0.5mol,设Mg、Al的物质的量分别为x、y,则![]() ,解得x=y=0.2mol,该混合物中Mg、Al的物质的量之比为0.2mol:0.2mol =1:1;
,解得x=y=0.2mol,该混合物中Mg、Al的物质的量之比为0.2mol:0.2mol =1:1;
(2)该Mg、Al的混合物与盐酸恰好完全反应,在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,生成氢氧化镁、氢氧化铝,且不发生HCl与NaOH的反应,
由原子守恒可知,n(NaOH)=2n(Mg)+3n(Al)=2×0.2mol+3×0.2mol=1mol,需要NaOH溶液的体积为![]() =0.5L=500mL;
=0.5L=500mL;
(3)若该Mg、Al混合物溶于400mL 3mol/L盐酸后,n(HCl)=0.4L×3mol/L=1.2mol,消耗n(HCl)=2n(Mg)+3n(Al)=2×0.2mol+3×0.2mol=1.0mol,
剩余HCl 1.2mol-1.0mol=0.2mol,
滴入NaOH溶液,使所得沉淀中无Al(OH)3,
则发生H++OH-=H2O,Mg2++2OH-=Mg(OH)2↓、Al3++4OH-=AlO2-+2H2O,
则需要n(NaOH)=n(HCl)+2n(Mg)+4n(Al)=0.2mol+2×0.2mol+4×0.2mol=1.4mol,
V(NaOH)=![]() =0.7L=700mL。
=0.7L=700mL。


 核心素养学练评系列答案
核心素养学练评系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:
【题目】硼镁泥是硼镁矿生产硼砂晶体(Na2B4O7·10H2O)时的废渣,其主要成分是MgO,还含有Na2B4O7、CaO、Fe2O3、FeO、MnO、SiO2等杂质。以硼镁泥为原料制取七水硫酸镁的工艺流程如下:

回答下列问题:
(l)Na2B4O7·10H2O中B的化合价为__________。
(2)Na2B4O7易溶于水,也易发生水解:B4O72-+7H2O![]() 4H3BO3(硼酸)+2OH-(硼酸在常温下溶解度较小)。写出加入硫酸时Na2B4O7发生反应的化学方程式:______________。
4H3BO3(硼酸)+2OH-(硼酸在常温下溶解度较小)。写出加入硫酸时Na2B4O7发生反应的化学方程式:______________。
(3)滤渣B中含有不溶于稀盐酸但能溶于热浓盐酸的黑色固体,写出生成黑色固体的离子方程式____________。
(4)加入MgO的目的是___________________。
(5)已知MgSO4、CaSO4的溶解度如下表:
温度(℃) 溶解度(g) | 40 | 50 | 60 | 70 |
MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
“操作A”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明“操作A”步骤为____________________。
(6)硼砂也能在工业上制取NaBH4,NaBH4被称为有机化学中的“万能还原剂”。
①写出NaBH4的电子式:___________。
②“有效氢含量”可用来衡量含氢还原剂的还原能力,其定义是:每克含氢还原剂的还原能力相当于多少克H2的还原能力。NaBH4的有效氢含量为_________(保留两位小数)。
③在碱性条件下,在阴极上电解NaBO2也可制得硼氢化钠,写出阴极室的电极反应式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素R、X、Y、Z 在周期表中的相对位置如图所示。已知: Y的最高价氧化物对应的水化物既能与强碱反应,又能与强酸反应。下列说法不正确的是
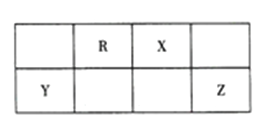
A. 简单气态氢化物的热稳定性: R<X
B. Y、Z的简单离子在同一溶液中能大量共存
C. 工业上,采用电解法冶炼单质Y
D. RZ2是含极性键的共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修5:有机化学基础]乙基香兰素是最重要的合成香料之一,常作为婴幼儿奶粉的添加剂。制备乙基香兰素的一种合成路线(部分反应条件略去)如下图所示:

已知:① R—ONa + R’—Br —→ R—O—R’ + NaBr
② Ⅲ中生成的Cu2O经氧化后可以循环利用
回答下列问题:
(1)A的核磁共振氢谱有3组峰。A的结构简式为 。
(2)Ⅰ中可能生成的一种烃是 (填名称);催化剂PEG可看作乙二醇脱水缩聚的产物,PEG的结构简式为 。若PEG的平均相对分子质量为17618,则其平均聚合度约为 。
(3)Ⅱ中,发生的反应属于 (填反应类型)。
(4)Ⅲ中,反应的化学方程式为 。
(5)Ⅳ中,有机物脱去的官能团是 (填名称)。
(6)D是乙基香兰素的同分异构体,其分子结构中不含乙基。由A制备D的一种合成路线(中间产物及部分反应条件略去)如下图所示:
C和D的结构简式分别为 、 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有常见的A~J物质存在如下转化关系示意图(反应条件已略去),已知通常情况下A为固态金属单质,B、D为气态非金属单质,E为淡黄色固体,F为无色液体,J为红褐色沉淀。请回答下列问题:
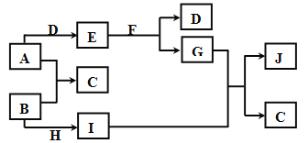
(1)写出下列物质的化学式:H________;D__________。
(2)写出下列转化的化学方程式或离子方程式:
①E+F→D+G的化学方程式:__________________________________;
②G+I→C+J的离子方程式:_________________________________。
(3)若要检验I物质的阳离子所加入的试剂是________________________。实验现象为:_______________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学选修3:物质结构与性质】铝、铁在生活、生产中有着广泛的用途,请回答下列问题。
(1)Fe2+的最外层电子排布式____________。元素Fe与Mn的第三电离能分别为I3(Fe)、I3(Mn),则I3(Fe)______I3(Mn)(填“>”、“<")。
(2)第四周期中,与Al原子未成对电子数相同的金属元素有____种。气态氯化铝的分子组成为(AlCl3)2,其中Al、Cl均达8e-稳定结构,Al原子的杂化方式为__________。根据等电子原理,AlO2-的空间构型为_____。
(3)Fe(CO)5的熔点为-20℃,沸点为103℃,易溶于乙醚,其晶体类型为______,晶体中σ键和π键的数目之比为______。
(4)科学家们发现某些含铁的物质可催化尿素合成肼(N2H4),沸点:N2H4>C2H6的主要原因为____________。
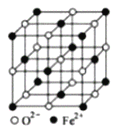
(5)FeO晶体的晶胞如图所示,己知:FeO晶体的密度为ρg/cm3,NA代表阿伏加德罗常数的值。在该晶胞中,与Fe2+紧邻且等距离的Fe2+数目为_____;Fe2+与O2-最短核间距为______pm(用ρ和NA表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用下列装置制氯气,请填空:
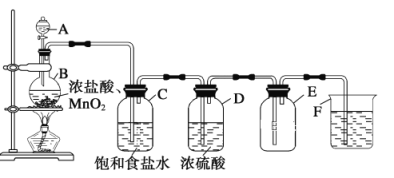
①制氯气的反应原理,请用化学方程式表示:______________。
②饱和食盐水的作用是_________________________________________________。
③浓硫酸的作用是_________________________________________________。
④氢氧化钠的作用是_________________________________________________。
⑤向上排空气法收集氯气的理由是_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数,下列说法中正确的是( )
A. 足量Fe与1molCl2完全反应,转移电子的数目为3NA
B. 22.4 L 氧气含有的分子数为NA
C. 常温常压下,28 g氮气所含的原子数为2NA
D. 0.1 mol/L的氯化铝溶液中,含有Cl的数目为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼(B)、铝(Al)、镓(Ga)均属于硼族元素(第ⅢA族),它们的化合物或单质都有重要用途。回答下列问题:
(1)写出基态镓原子的电子排布式____________。
(2)已知:无水氯化铝在178℃升华,它的蒸气是缔合的双分于(Al2Cl6),更高温度下Al2Cl6则离解生成A1Cl3单分子。
①固体氯化铝的晶体类型是______________;
②写出Al2Cl6分子的结构式_______________;
③单分子A1Cl3的立体构型是__________,缔合双分子Al2Cl6中Al原子的轨道杂化类型是_______。
(3)晶体硼的结构单元是正二十面体,每个单元中有12个硼原子(如图),若其中有两个原子为10B,其余为11B,则该结构单元有____________种不同的结构类型。

(4)金属铝属立方晶系,其晶胞边长为405 pm,密度是2.70g·cm3,计算确定其晶胞的类型(简单、体心或面心立方)________________;晶胞中距离最近的铝原子可看作是接触的,列式计算铝的原子半径r(A1)=______________pm。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com