
【题目】【化学选修3:物质结构与性质】铝、铁在生活、生产中有着广泛的用途,请回答下列问题。
(1)Fe2+的最外层电子排布式____________。元素Fe与Mn的第三电离能分别为I3(Fe)、I3(Mn),则I3(Fe)______I3(Mn)(填“>”、“<")。
(2)第四周期中,与Al原子未成对电子数相同的金属元素有____种。气态氯化铝的分子组成为(AlCl3)2,其中Al、Cl均达8e-稳定结构,Al原子的杂化方式为__________。根据等电子原理,AlO2-的空间构型为_____。
(3)Fe(CO)5的熔点为-20℃,沸点为103℃,易溶于乙醚,其晶体类型为______,晶体中σ键和π键的数目之比为______。
(4)科学家们发现某些含铁的物质可催化尿素合成肼(N2H4),沸点:N2H4>C2H6的主要原因为____________。
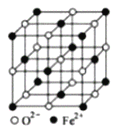
(5)FeO晶体的晶胞如图所示,己知:FeO晶体的密度为ρg/cm3,NA代表阿伏加德罗常数的值。在该晶胞中,与Fe2+紧邻且等距离的Fe2+数目为_____;Fe2+与O2-最短核间距为______pm(用ρ和NA表示)。
【答案】 3s23p63d6 < 4 sp3 直线型 分子晶体 1:1 前者可形成分子间氢键,后者只有范德华力 12 ![]() ×1010
×1010
【解析】(1) 核外电子排布是按能级顺序排布的,但在化学反应中失去电子是按从最外层到次外层依次失去,所以Fe2+的最外层电子排布式3s23p63d6;铁元素失去的第三个电子是3d6上的电子,而3d6容易失去一个电子形成比较稳定的3d5半充满状态,而Mn的价电子排布式为3d53s2,失去的第三个电子是3d5上的电子,这是个比较稳定的半充满状态,所以难易失去,因此I3(Fe) <I3(Mn);
(2) Al原子未成对电子数为1,所以在第四周期中,未成对电子数也是1个的有K、Sc、Cu、Ga共四种元素;根据气态氯化铝的分子组成为(AlCl3)2,要使每个原子都达到8e-稳定结构,Al除与三个Cl形成三个共键单键外,还要由Cl提供一个配位键,所以需要采用sp3的杂化方式形成四个等价的共价键;AlO2-中含有16个价电子,与CO2所含原子数相同、价电子数也相同,根据等电子原理,AlO2-的空间构型为直线型;
(3)根据Fe(CO)5的物理性质(熔沸点低,易溶于有机溶剂)可判断其为分子晶体;在CO原子团内有一个σ键和一个π键,所以该晶体中σ键和π键的数目之比为1:1;
(4)在N2H4分子内有N—H键,所以能够在分子间形成氢键,而C2H6分子只有范德华力,所以前者沸点高于后者;
(5)分析该晶胞结构可知与Fe2+紧邻的Fe2+就是面对角线1/2线段两端的两个小黑球,距离相等的小黑球有12个;该晶体中含有的Fe=(1/8)×8+(1/2)×6=4,O=1+(1/4)×12=4,即含有4个FeO分子,所以该晶胞的质量m=72×4/NAg,其棱长a=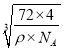 cm,而Fe2+与O2-最短核间距为棱长的一半,即
cm,而Fe2+与O2-最短核间距为棱长的一半,即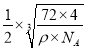 ×1010pm =
×1010pm =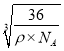 ×1010 pm。
×1010 pm。


科目:高中化学 来源: 题型:
【题目】1﹣丁醇和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115~l25℃,反应装置如图.下列对该实验的描述错误的是( )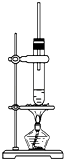
A.不能用水浴加热
B.长玻璃管起冷凝回流作用
C.提纯乙酸丁酯需要经过水、氢氧化钠溶液洗涤
D.加入过量乙酸可以提高1﹣丁醇的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色稀溶液X中,可能含有下表所列离子中的某几种.
阴离子 | CO32﹣、SiO32﹣、AlO2﹣、Cl﹣ |
阳离子 | Al3+、Fe3+、Mg2+、NH4+、Na+ |
现取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂体积(V)的关系如图所示.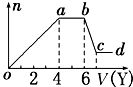
(1)若Y是盐酸,则oa段转化为沉淀的离子(指来源于X溶液的,下同)是 , ab段发生反应的离子是 , bc段发生反应的离子方程式为 .
(2)若Y是NaOH溶液,则X中一定含有的阳离子是 , 其物质的量之比为 , ab段反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜锌原电池的装置如图所示,下列叙述不正确的是( ) 
A.锌片为负极,稀硫酸是电解质溶液
B.电池工作时电子由锌片经导线流向铜片
C.电池工作时铜片逐渐溶解而质量减轻
D.电池工作时实现了化学能转化为电能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是利用废铜屑(含杂质)制备胆矾(硫酸铜晶体)的过程 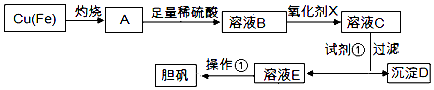
已知:
溶液中被沉淀的离子 | Fe3+ | Fe2+ | Cu2+ |
完全生成氢氧化物的沉淀时,溶液的pH | ≥3.7 | ≥6.4 | ≥4.4 |
请回答:
(1)下列物质中最适宜做氧化剂X的是(填字母).
A.NaClO
B.H2O2
C.KMnO4
D.FeCl3
(2)加入试剂①是为了调节pH,试剂①可以选择(填化学式).
(3)操作①的名称是 .
(4)沉淀D加入盐酸可以得到FeCl3溶液,关于FeCl3溶液的性质中说法不正确的是 .
A.将FeCl3饱和溶液逐滴加入沸水中,并继续加热得到红褐色液体,该液体能产生丁达尔效应
B.向FeCl3溶液滴加NaOH溶液,出现红褐色沉淀
C.将FeCl3溶液滴加NaOH溶液,将沉淀干燥灼烧,得到Fe(OH)3固体
D.向FeCl3溶液中滴加KSCN溶液,溶液变为红色
(5)沉淀D加入盐酸和铁粉,可以制得FeCl2溶液,实验室保存FeCl2溶液,需加入过量的铁粉防止FeCl2溶液变质,其原因是(用离子方程式表示).
(6)若用碳电极电解硫酸铜溶液200mL.通电5min后,阴极增重0.64g,则电解后溶液的pH=(溶液体积变化忽略不计).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列排列顺序不正确的是
A.原子半径:Na>Si>OB.热稳定性:HF>H2O>NH3
C.碱性:CsOH>KOH>NaOHD.失电子能力:Al>Mg>Na
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】维生素C的结构简式如图所示.下列有关说法正确的是:( ) 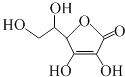
A.维生素C所含的官能团有羟基、羧基、碳碳双键
B.维生素C能和溴水、酸性重铬酸钾溶液反应
C.维生素C的分子式为C6H6O6
D.维生素C能发生加成反应、氧化反应,不能发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于生物体内有机化合物所含元素的叙述,错误的是( )
A. 叶绿素含有镁元素,血红蛋白含有铁元素
B. 脱氧核糖和ATP均含有磷元素
C. 甲状腺激素含有碘元素,不能为细胞供能
D. 胰岛素含有氮元素,能调节生命活动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com