
【题目】如图是利用废铜屑(含杂质)制备胆矾(硫酸铜晶体)的过程 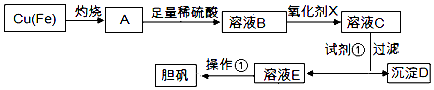
已知:
溶液中被沉淀的离子 | Fe3+ | Fe2+ | Cu2+ |
完全生成氢氧化物的沉淀时,溶液的pH | ≥3.7 | ≥6.4 | ≥4.4 |
请回答:
(1)下列物质中最适宜做氧化剂X的是(填字母).
A.NaClO
B.H2O2
C.KMnO4
D.FeCl3
(2)加入试剂①是为了调节pH,试剂①可以选择(填化学式).
(3)操作①的名称是 .
(4)沉淀D加入盐酸可以得到FeCl3溶液,关于FeCl3溶液的性质中说法不正确的是 .
A.将FeCl3饱和溶液逐滴加入沸水中,并继续加热得到红褐色液体,该液体能产生丁达尔效应
B.向FeCl3溶液滴加NaOH溶液,出现红褐色沉淀
C.将FeCl3溶液滴加NaOH溶液,将沉淀干燥灼烧,得到Fe(OH)3固体
D.向FeCl3溶液中滴加KSCN溶液,溶液变为红色
(5)沉淀D加入盐酸和铁粉,可以制得FeCl2溶液,实验室保存FeCl2溶液,需加入过量的铁粉防止FeCl2溶液变质,其原因是(用离子方程式表示).
(6)若用碳电极电解硫酸铜溶液200mL.通电5min后,阴极增重0.64g,则电解后溶液的pH=(溶液体积变化忽略不计).
【答案】
(1)B
(2)CuO或CuCO3或Cu(OH)2
(3)蒸发浓缩、冷却结晶
(4)C
(5)Fe+2Fe3+=3Fe2+
(6)1
【解析】解:(1)氧化剂X是将亚铁离子氧化成铁离子,同时不能引入新的杂质,所以可以用H2O2;
所以答案是:B;(2)加入试剂①是为了调节pH,与溶液中的氢离子反应,同时不能引入新的杂质,试剂①可以选择CuO或CuCO3或Cu(OH)2;
所以答案是:CuO或CuCO3或Cu(OH)2;(3)操作①是从硫酸铜 溶液中获得硫酸铜晶体,其名称是蒸发浓缩、冷却结晶;
所以答案是:蒸发浓缩、冷却结晶;(4)A.将FeCl3饱和溶液逐滴加入沸水中,并继续加热得到红褐色液体为氢氧化铁胶体,氢氧化铁胶体能产生丁达尔效应,故A正确;
B.向FeCl3溶液滴加NaOH溶液,生成氢氧化铁红褐色沉淀,故B正确;
C.将FeCl3溶液加热蒸干并灼烧,由于氯化铁水解,最终得到Fe2O3固体,故C错误;
D.向FeCl3溶液中滴加KSCN溶液生成Fe(SCN)3,溶液变为红色,故D正确;
所以答案是:C;(5)实验室保存FeCl2溶液,需加入过量的铁粉防止FeCl2溶液变质,铁粉有还原性,离子方程式为:Fe+2Fe3+=3Fe2+;
所以答案是:Fe+2Fe3+=3Fe2+;(6)用碳电极电解硫酸铜溶液200mL.通电5min后,阴极增重0.64g,阴极为为铜离子放电得铜单质,即生成Cu的物质的量为 ![]() =0.01mol,根据铜和氢离子的关系式Cu~2H+知,氢离子的物质的量为0.02mol,溶液中氢离子浓度为
=0.01mol,根据铜和氢离子的关系式Cu~2H+知,氢离子的物质的量为0.02mol,溶液中氢离子浓度为 ![]() =0.1mol/L,则溶液的pH=lgc(H+)=1;
=0.1mol/L,则溶液的pH=lgc(H+)=1;
所以答案是:1.


科目:高中化学 来源: 题型:
【题目】请按要求回答下列问题:
(1)非诺洛芬是治疗类风湿性关节炎的药物,其结构简式如图:
①非诺洛芬的含氧官能团名称为 , ②非诺洛芬能发生的有机反应类型有 .
(2)写出下列反应的化学方程式:
①在加热、加压和催化剂条件下乙烯与水反应: .
②CH2=CHCOOCH2CH3的聚合反应: . 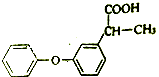
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于胶体的叙述正确的是
A.Fe(OH)3胶体是纯净物
B.胶体是比溶液还稳定的分散系
C.胶体粒子直径在 1~100 nm之间
D.将饱和FeCl3溶液滴加到沸水中长时间加热制得Fe(OH)3胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国钒钛磁铁矿分布广泛,储量丰富,不仅是铁的重要来源,其中伴生的钛、钒、铝等多种成分还具有很高的利用价值。其尾矿是工业提取钛的重要来源
I.钒钛磁铁矿的尾矿(主要成分为FeTiO3,还含有少量FeO、Al2O3、SiO2等杂质)经选矿后得到钛精矿过一系列反应制得TiO2:

(1)氢氧化钠净化尾矿的目的是_________________________________。
(2)写出钛精矿中FeTiO3与80%硫酸溶液反应的化学方程式:___________________。
II.以TiO2为原料制备金属钛,流程如下:TiO2→TiCl4→Ti
(3)已知反应:TiO2(s)十2Cl2(g)=TiCl4(l)十O2(g) △H=十151kJ/mol,但不能由TiO2和Cl2直接反应(即氯化反应)来制取TiCl4试解释原因:___________________________________。
(4)当往氯化反应体系中加入碳后,使得该反应在高温条件下能顺利制得TiCl4,从化学平衡的角度解释其原因___________________________________________。
(5)己知碳的燃烧热394kJ/mol,请写出TiO2与Cl2、C反应制取TiCl4的热化学方程式_____________。
III.以TiO2为原料可以制备Li4Ti5O12(一种锂离子电池的电极材料),过程如下:
![]()
(6)不同温度下,TiO2·xH2O与双氧水、氨水反应达到平衡所得实验结果如下表所示:
温度/℃ | 30 | 35 | 40 | 45 | 50 |
TiO2·xH2O的转化率 | 80% | 90% | 97% | 93% | 82% |
该过程的理想温度为_______________,分析表中数据,解释TiO2·xH2O的转化率随温度变化的原因:_______________________________________,该反应的离子方程式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学选修3:物质结构与性质】铝、铁在生活、生产中有着广泛的用途,请回答下列问题。
(1)Fe2+的最外层电子排布式____________。元素Fe与Mn的第三电离能分别为I3(Fe)、I3(Mn),则I3(Fe)______I3(Mn)(填“>”、“<")。
(2)第四周期中,与Al原子未成对电子数相同的金属元素有____种。气态氯化铝的分子组成为(AlCl3)2,其中Al、Cl均达8e-稳定结构,Al原子的杂化方式为__________。根据等电子原理,AlO2-的空间构型为_____。
(3)Fe(CO)5的熔点为-20℃,沸点为103℃,易溶于乙醚,其晶体类型为______,晶体中σ键和π键的数目之比为______。
(4)科学家们发现某些含铁的物质可催化尿素合成肼(N2H4),沸点:N2H4>C2H6的主要原因为____________。
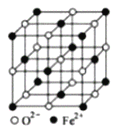
(5)FeO晶体的晶胞如图所示,己知:FeO晶体的密度为ρg/cm3,NA代表阿伏加德罗常数的值。在该晶胞中,与Fe2+紧邻且等距离的Fe2+数目为_____;Fe2+与O2-最短核间距为______pm(用ρ和NA表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知正四面体形分子E和直线型分子G反应,生成四面体形分子L和双原子分子M.(组成E分子的元素的原子序数都小于10,组成G分子的元素为第三周期的元素.)如图,则下列判断中正确的是( ) 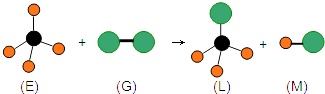
A.常温常压下,L是一种液态有机物
B.E中化学键是极性键
C.G有漂白性
D.上述反应的类型是加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体血红蛋白中含有Fe2+离子,如果误食亚硝酸盐,会使人中毒,因为亚硝酸盐会使Fe2+离子转变成Fe3+离子,生成高铁血红蛋白而丧失与O2结合的能力.服用维生素C可缓解亚硝酸盐的中毒,这说明维生素C具有( )
A.酸性
B.碱性
C.氧化性
D.还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积均为1 L的三个密闭容器中,分别放入铁粉并充入1 mol CO,控制在不同温度下发生反应:Fe(s)+5CO(g) ![]() Fe(CO)5(g),当反应进行到5min时,测得CO的体积分数与温度的关系如图所示。下列说法一定正确的是( )
Fe(CO)5(g),当反应进行到5min时,测得CO的体积分数与温度的关系如图所示。下列说法一定正确的是( )
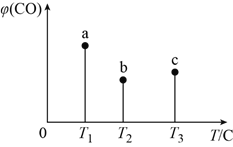
A. 反应进行到5min时,b容器中v(正)=v(逆)
B. 正反应为吸热反应,平衡常数:K(T1)>K(T2)
C. b中v(正)大于a中v(逆)
D. 达到平衡时,a、b、c中CO的转化率为b>c>a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 用石墨作电极电解食盐水时,若阴极得到2NA个电子,则阳极一定产生22.4 LCl2(已折换算成标准状况下的体积)
B. 2 L 0.05 mol·L-1乙醇溶液中含有H原子数目为0.1NA
C. 4.0 g H![]() O与D2O的混合物中所含中子数为2NA
O与D2O的混合物中所含中子数为2NA
D. 常温下,1 mol的NaHCO3固体中HCO![]() 的个数必定小于NA
的个数必定小于NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com