
【题目】某化学小组欲进行如下的实验探究金属与浓硫酸反应。试回答下列问题:
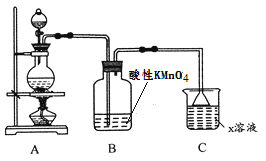
(1)利用上图装置研究铜与浓硫酸反应,反应的化学方程式为_____________________。
(2)C装置的作用___________________。
(3)将上述实验中的铜改为铁,在常温下进行,无明显现象,其原因是_______________。在加热条件下,实验的后阶段可观察到倒立的漏斗边沿有气体冒出,该气体可能为_______。
(4)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、Al2O3及不溶于强酸的SiO2)可制备Fe2O3。①用稀盐酸浸取炉渣,过滤;②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。据以上信息回答下列问题:
a.除去Al3+的离子方程式是______________________________。
b.步骤②中滤液氧化的目的是_____________________________。
【答案】Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O 吸收多余的SO2,防止污染空气,防倒吸 在常温下,铁在浓硫酸中钝化 氢气或H2 Al3++4OH-=AlO2-+2H2O 将Fe2+氧化为Fe3+
CuSO4+SO2↑+2H2O 吸收多余的SO2,防止污染空气,防倒吸 在常温下,铁在浓硫酸中钝化 氢气或H2 Al3++4OH-=AlO2-+2H2O 将Fe2+氧化为Fe3+
【解析】
应用铝、铁、铜及其化合物的性质,结合浓硫酸的性质分析解答。
(1)铜与浓硫酸反应需要加热,化学方程式为Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O;
CuSO4+SO2↑+2H2O;
(2)SO2是有毒气体,装置C中溶液可吸收多余的SO2,防止污染空气;SO2在水中溶解度较大,装置C中倒置漏斗可防倒吸;
(3)常温下,铁在浓硫酸中会钝化表面形成致密氧化膜。加热条件下,铁与浓硫酸的反应能持续进行,使硫酸浓度减小。反应后期,铁与稀硫酸的反应放出氢气;
(4)a.过量NaOH溶液将Al3+变成AlO2-,离子方程式是Al3++4OH-=AlO2-+2H2O。
b.炉渣中FeO在酸溶时生成了Fe2+,而产品是Fe2O3。故滤液氧化的目的将Fe2+氧化为Fe3+。


科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A. 图1表示常温下,将SO2气体通入溴水中,所得溶液pH的变化
B. 图2表示向NH4A1(SO4)2溶液中逐滴滴入NaOH溶液,沉淀总物质的量(n)随NaOH溶液体积(V)的变化
C. 图3表示T °C时,对于可逆反应:A(g)+B(g)![]() 2C(g) +D(g)ΔH>0,正、逆反应速率与压强的关系
2C(g) +D(g)ΔH>0,正、逆反应速率与压强的关系
D. 图4表示常温下,几种难溶氢氧化物的饱和溶液中金属离子浓度的负对数与溶液PH的关系,则在pH = 7的溶液中,Fe3+、A13+、Fe2+能大量共存
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向50 mL 18 mol·L-1的H2SO4溶液中加入适量的铜片并加热。充分反应后,被还原的H2SO4的物质的量( )
A. 小于0.45 mol B. 等于0.45 mol
C. 在0.45~0.90 mol之间 D. 大于0.45 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其化合物在科学研究和工业生产中具有许多用途。请回答下列问题:
(1)画出基态Cu原子的价电子排布图__________________;
(2)已知高温下Cu2O比CuO稳定,从核外电子排布角度解释高温下Cu2O更稳定的原因_________________________________________________________________________。
(3)配合物[Cu(NH3)2]OOCCH3中碳原子的杂化类型是____________,配体中提供孤对电子的原子是____________。C、N、O三元素的第一电离能由大到小的顺序是__________(用元素符号表示)。
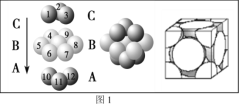
(4)铜晶体中铜原子的堆积方式如图1所示,则晶体铜原子的堆积方式为________________。
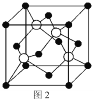
(5)M原子的价电子排布式为3s23p5,铜与M形成化合物的晶胞如图2所示(白球代表铜原子)。
①该晶体的化学式为_________________。
②已知铜和M的电负性分别为1.9和3.0,则铜与M形成的化合物属于_________化合物(填“离子”、“共价”)
③已知该晶体的密度为![]() g/cm3,阿伏加德罗常数的值为NA,则该晶体中Cu原子和M原子之间的最短距离为_________pm(写出计算式)。
g/cm3,阿伏加德罗常数的值为NA,则该晶体中Cu原子和M原子之间的最短距离为_________pm(写出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属和非金属被广泛应用于人类生产生活中。
(1)胃液中含有盐酸,胃酸过多的人常有胃疼烧心的感觉,易吐酸水,服用含有小苏打的药品以中和过多的胃酸,其反应的离子方程式:___________________________;
(2)中华透明牙膏摩擦剂SiO2是工业制备晶体硅的原料,工业上制粗硅的反应原理是 __________;(用化学反应方程式表示)。
(3)硅酸钠的水溶液俗称水玻璃,向其中通入过量的CO2,会出现胶状沉淀,其离子方程式是_________;
(4)人体血红蛋白中含有Fe2+,若误食亚硝酸盐,会导致Fe2+转化Fe3+而中毒,服用维生素C可以解毒.对上述的分析正确的是(______)
A.亚硝酸盐是还原剂 B.维生素C是氧化剂
C.维生素C被氧化 D.亚硝酸盐发生氧化反应
(5)化学与生产、生活、社会等密切相关,下列说法正确的是(_______)
A. 二氧化硫具有漂白性,可用来增白纸浆、草帽辫、食品等
B. 酸雨是空气中二氧化碳含量超标引起的
C.工业上合成氨气可用浓氨水和生石灰混合制得
D.蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有吸水性
E.洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一,漂白粉是常用的消毒剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】结合某城市某日空气质量报告内容,以下叙述正确的是

A. 该日空气首要污染物是PM2.5
B. 该日空气质量等级属于优
C. 污染物NO2、CO可能主要来源于机动车尾气
D. PM2.5、PM10指的是悬浮颗粒物,不会影响人体健康
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,回答下列有关问题:
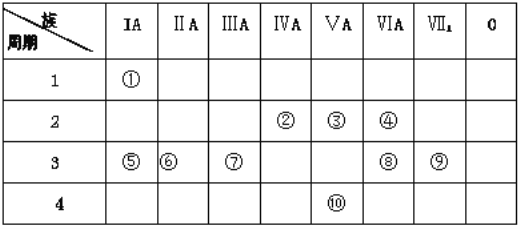
(1)从⑤到⑨元素中非金属性较强的元素是_________(用元素符号表示),这些元素的最高价氧化物对应的水化物中碱性最强的是 _________ (填化学式)。
(2)写出元素④具有强氧化性的氢化物的电子式:_______________。
(3)写出一种由①、③、④三种元素形成的常见离子化合物:________________。
(4)用电子式表示⑥、⑨形成化合物的过程:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将物质的量均为a mol的钠和铝一同投入m g足量的水中,所得溶液的密度为ρg/cm3,则此溶液的物质的量浓度为 ( )
A.1000aρ / (50a+m) mol/L B.aρ / (46a+m) mol/L
C.1000aρ / (46a+m) mol/L D.1000aρ / (47a+m) mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:

回答下列问题:
(1)滤渣1为_______________,操作A为_________________,向滤液②中加入双氧水的作用是___________________________________。
(2)“酸浸”后,钛主要以TiOCl42-形式存在,写出相应反应的离子方程式__________。
(3)TiO2·xH2O沉淀与双氧水、氨水反应40 min所得实验结果如下表所示:
温度/℃ | 30 | 35 | 40 | 45 | 50 |
TiO2·xH2O转化率% | 92 | 95 | 97 | 93 | 88 |
分析40℃时TiO2·xH2O转化率最高的原因_______________________________。
(4)若“滤液②”中c(Mg2+)=0.02 mol/L,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1×10-5 mol/L,此时是否有Mg3(PO4)2沉淀生成?_____________________________________________(列式计算)。FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0×10-24。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com