
【题目】Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:

回答下列问题:
(1)滤渣1为_______________,操作A为_________________,向滤液②中加入双氧水的作用是___________________________________。
(2)“酸浸”后,钛主要以TiOCl42-形式存在,写出相应反应的离子方程式__________。
(3)TiO2·xH2O沉淀与双氧水、氨水反应40 min所得实验结果如下表所示:
温度/℃ | 30 | 35 | 40 | 45 | 50 |
TiO2·xH2O转化率% | 92 | 95 | 97 | 93 | 88 |
分析40℃时TiO2·xH2O转化率最高的原因_______________________________。
(4)若“滤液②”中c(Mg2+)=0.02 mol/L,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1×10-5 mol/L,此时是否有Mg3(PO4)2沉淀生成?_____________________________________________(列式计算)。FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0×10-24。
【答案】SiO2过滤将Fe2+氧化为Fe3+FeTiO3+ 4H+ + 4Cl=Fe2++ TiOCl42 + 2H2O低于40℃,TiO2·xH2O转化反应速率随温度升高而增加;超过40℃,双氧水分解与氨气逸出导致TiO2·xH2O转化反应速率下降Fe3+恰好沉淀完全时,c(PO43-)=![]() mol·L1=1.3×10-17 mol·L1,c3(Mg2+)×c2(PO43-)=(0.01)3×(1.3×10-17)2=1.7×10-40<Ksp Mg3(PO4)2],因此不会生成Mg3(PO4)2沉淀
mol·L1=1.3×10-17 mol·L1,c3(Mg2+)×c2(PO43-)=(0.01)3×(1.3×10-17)2=1.7×10-40<Ksp Mg3(PO4)2],因此不会生成Mg3(PO4)2沉淀
【解析】
(1)主要成分为FeTiO3,还含有少量MgO、SiO2等杂质,其中SiO2不溶于酸,所以滤渣为SiO2;滤液1中钛粒子水解生成沉淀,因此分离方法是过滤;双氧水具有氧化性,滤液中含有亚铁离子,因此,加入双氧水的作用是将溶液中的Fe2+氧化为Fe3+;
(2)酸浸后,FeTiO3溶于酸,反应方程式为:FeTiO3+ 4H+ + 4Cl=Fe2++ TiOCl42 + 2H2O;
(3)温度是影响速率的主要因素,但双氧水在高温下易分解、氨水易挥发,即原因低于40℃,TiO2·xH2O转化反应速率随温度升高而增加;超过40℃,双氧水分解与氨气逸出导致TiO2·xH2O转化反应速率下降;
(4)Fe3+恰好沉淀完全时,根据![]() 可知
可知
c(PO43-)=![]() mol·L1=1.3×10-17 mol·L1,c3(Mg2+)×c2(PO43-)=(0.01)3×(1.3×10-17)2=1.7×10-40<Ksp Mg3(PO4)2],因此不会生成Mg3(PO4)2沉淀。
mol·L1=1.3×10-17 mol·L1,c3(Mg2+)×c2(PO43-)=(0.01)3×(1.3×10-17)2=1.7×10-40<Ksp Mg3(PO4)2],因此不会生成Mg3(PO4)2沉淀。


科目:高中化学 来源: 题型:
【题目】某化学小组欲进行如下的实验探究金属与浓硫酸反应。试回答下列问题:
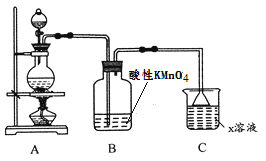
(1)利用上图装置研究铜与浓硫酸反应,反应的化学方程式为_____________________。
(2)C装置的作用___________________。
(3)将上述实验中的铜改为铁,在常温下进行,无明显现象,其原因是_______________。在加热条件下,实验的后阶段可观察到倒立的漏斗边沿有气体冒出,该气体可能为_______。
(4)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、Al2O3及不溶于强酸的SiO2)可制备Fe2O3。①用稀盐酸浸取炉渣,过滤;②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。据以上信息回答下列问题:
a.除去Al3+的离子方程式是______________________________。
b.步骤②中滤液氧化的目的是_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2是国内外允许使用的一种食品添加剂,在食品工业中发挥着护色、防腐、漂白和抗氧化的作用。我国对于SO2的添加量有明确规定(如图所示)。

某研究小组用图装置对市售黄花菜中的SO2进行测定。其中,溶液X为黄花菜进行充分浸泡后所得浅黄色浸泡液,Y为加入的试剂。(Y的浓度及体积均未标出)查阅资料发现,在水溶液中正四价硫元素主要以SO32-形式存在,且SO2与SO32-化学性质相似。因此,该小组同学将SO2的测定问题转化为溶液中SO32-的测定。
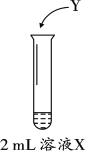
(1)结合化学知识解释浸泡液X中存在SO32-的原因是______。
(2)甲同学预测可用Na2S溶液验证X中是否含有SO32-,该预测应用的是Na2S的______性。查阅资料发现该反应较为复杂,因此未做进一步验证。
(3)乙同学为验证X中是否含有SO32-,进行了实验i:
实验序号 | 试剂Y | 现象 |
i | 酸性KMnO4溶液 | ① |
根据实验i 的现象得出结论:X中含有SO32-。实验i的现象是________,SO32-在反应后转化为_________。
(4)丙同学认为也可以用H2O2溶液来验证X中是否含有SO32-,进行了实验ii:
实验序号 | 操作 | 现象 |
ii | a.向X中加入适量H2O2溶液,振荡 | 无明显现象 |
b.继续滴加 ,振荡 | 无明显现象 | |
c.再滴加 ,振荡 | 白色沉淀 |
通过实验ii可证明X中含有SO32-,写出操作b、c中滴加试剂的化学式____、 _____ 。
(5)丁同学认为丙的实验方案不严谨,设计了对比实验ⅲ,证明了X中含有SO32-。实验ⅲ的方案是(从操作、现象、结论方面描述)________ 。
(6)为测定市售黄花菜中SO2含量,进行实验ⅳ:
实验序号 | 操作 |
ⅳ | a.将50克黄花菜研碎,用一定浓度氢氧化钠溶液浸泡; b.加稀硫酸酸化; c.加入淀粉指示剂; d.用浓度为0.01mol/L的I2溶液滴定,消耗0.01mol/L的I2溶液5.00 mL。 |
查阅资料发现:碘元素的常见价态有-1,0,+1,+3,+5,+7。
① 将黄花菜用氢氧化钠溶液浸泡的目的是(用化学方程式表示)__________。
② 写出滴定反应的化学方程式____________。
③ 该市售黄花菜中SO2残留量是________毫克/千克。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时。有c(CH3COOH)+ c(CH3COO-)=0.1mol/L的醋酸、醋酸钠混合溶液,c(CH3COOH)、c(CH3COO-) 与pH的关系如图所示。下列有关溶液的叙述不正确的是。
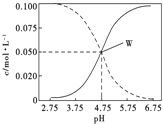
A. pH=5.5的溶液中c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)
B. 溶液中:c(H+)+ c(Na+)=c(CH3COO-)+c(OH-)
C. 由W点可以求出25℃时CH3COOH的电离常数
D. pH=4的溶液中: c(H+)+ c(Na+)+c(CH3COOH)=0.1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是一种理想的“绿色能源”,利用氢能需要选择合适的储氢材料。目前正在研究和使用的储氢材料有镁系合金、稀土系合金等。
(1)已知,Mg(s) +H2(g)==MgH2(s) △H=-74.5kJ/mol
Mg2Ni(s) + 2H2(g)==Mg2NiH4(s) △H=-64.4kJ/mol
MgNi(s)+ 2MgH2(s)==2Mg(s)+ Mg2NiH4(s) △H=____kJ/mol。
(2)储氢材料Mg(AlH4)2在110~200℃的反应为:Mg(AlH4)2==MgH2+2Al+3H2↑。反应中每转移3mol电子时,产生的H2在标准状况下的体积为_____________L。
(3)镧镍合金在一定条件下可吸收氢气形成氢化物:LaNi5(s)+3H2(g) ![]() LaNi5H6(s) △H<0,欲使LaNi5H6(s)释放出气态氢,根据平衡移动原理,可改变的条件是_________(填字母编号)。
LaNi5H6(s) △H<0,欲使LaNi5H6(s)释放出气态氢,根据平衡移动原理,可改变的条件是_________(填字母编号)。
a.增加LaNi5H6(s)的量 b.升高温度 c.减小压强 d.使用催化剂
(4)储氢还可借助有机物,如利用环己烷和苯之间的可逆反应来实现脱氢和加氢:![]()
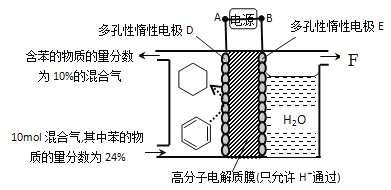
①某温度下,向恒容密闭容器中加入环己烷,起始浓度为amol·L-1,平衡时苯的浓度为b mol·L-1,该反应的平衡常数K=_____________(用含a、b的代数式表示)。
②一定条件下,下图装置可实现有机物的电化学储氢(忽略其它有机物)。A是电源的__________极(填“正”或“负”);电解过程中产生的气体F为________(填化学式):电极D上发生的电极反应为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验不合理的是
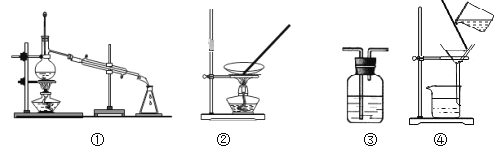
A. 用浓硫酸干燥SO2,选③
B. 从食盐溶液中获取NaCl,选②
C. 除去自来水中的Cl-,制纯净水,选④和①
D. 除去Fe(OH)3胶体中的难溶物,选④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下面的反应路线及所给信息填空。

(1)A的结构简式是 ,名称是 。
(2)①的反应类型是 ,③的反应类型是 。
(3)反应④ 的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某香料I的一种合成路线如下:

回答下列问题:
(1)C的名称为______________;H所含官能团名称是______________。
(2)B→C的反应类型是______________;写出I的结构简式:______________。
(3)G分子最多有______________个原子共平面。
(4)写出A→B的化学方程式:____________________________。
(5)J是I的同分异构体,同时满足下列条件的J的结构有_______种。其中,一种核磁共振氢谱有6个峰且峰的面积之比为1∶1∶1∶2∶2∶3的结构简式为______________。
①能使溴的四氯化碳溶液褪色
②能与碳酸氢钠溶液反应产生CO2
③属于芳香族化合物,且苯环上的一氯代物只有2种
(6)参照上述流程,以乙烯和OHC-CHO为原料合成HOOCCH=CHCOOH,设计合成路线:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烷烃可以由相应的烯烃经催化加氢得到,有一种烷烃A,分子式为C9H20,它却不能由任何C9H18的烯烃催化加氢得到。而另有A的三个同分异构体B1、B2、B3,分别可以而且只能由一种相应的烯烃催化加氢得到,推断并写出A、B1、B2、B3的结构简式为:A________,B1______________,B2__________,B3_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com