
【题目】25℃时。有c(CH3COOH)+ c(CH3COO-)=0.1mol/L的醋酸、醋酸钠混合溶液,c(CH3COOH)、c(CH3COO-) 与pH的关系如图所示。下列有关溶液的叙述不正确的是。
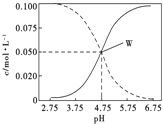
A. pH=5.5的溶液中c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)
B. 溶液中:c(H+)+ c(Na+)=c(CH3COO-)+c(OH-)
C. 由W点可以求出25℃时CH3COOH的电离常数
D. pH=4的溶液中: c(H+)+ c(Na+)+c(CH3COOH)=0.1mol/L
【答案】D
【解析】A、pH=5时溶液显酸性,既有c(H+)>c(OH-),根据图像,实线表示的是c(CH3COO-),虚线表示为c(CH3COOH),当pH=5时,c(CH3COO-)>c(CH3COOH),因此离子浓度大小顺序是c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-),故A说法正确;B、根据电荷守恒,c(H+)+c(Na+)=c(CH3COO-)+c(OH-),故B说法正确;C、电离平衡常数只受温度的影响,醋酸的电离常数Ka=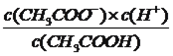 ,W点时c(CH3COOH)=c(CH3COO-),此时的pH=4.75,即c(H+)=10-4.75mol·L-1,代入公式得出Ka=10-4.75,故C说法正确;D、根据电荷守恒,c(H+)+c(Na+)=c(CH3COO-)+c(OH-),c(H+)+c(Na+)+c(CH3COOH)=c(CH3COO-)+c(OH-)+c(CH3COOH),得出:c(H+)+c(Na+)+c(CH3COOH)=c(OH-)+0.1mol·L-1,故D说法错误。
,W点时c(CH3COOH)=c(CH3COO-),此时的pH=4.75,即c(H+)=10-4.75mol·L-1,代入公式得出Ka=10-4.75,故C说法正确;D、根据电荷守恒,c(H+)+c(Na+)=c(CH3COO-)+c(OH-),c(H+)+c(Na+)+c(CH3COOH)=c(CH3COO-)+c(OH-)+c(CH3COOH),得出:c(H+)+c(Na+)+c(CH3COOH)=c(OH-)+0.1mol·L-1,故D说法错误。


科目:高中化学 来源: 题型:
【题目】铜及其化合物在科学研究和工业生产中具有许多用途。请回答下列问题:
(1)画出基态Cu原子的价电子排布图__________________;
(2)已知高温下Cu2O比CuO稳定,从核外电子排布角度解释高温下Cu2O更稳定的原因_________________________________________________________________________。
(3)配合物[Cu(NH3)2]OOCCH3中碳原子的杂化类型是____________,配体中提供孤对电子的原子是____________。C、N、O三元素的第一电离能由大到小的顺序是__________(用元素符号表示)。
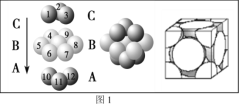
(4)铜晶体中铜原子的堆积方式如图1所示,则晶体铜原子的堆积方式为________________。
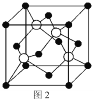
(5)M原子的价电子排布式为3s23p5,铜与M形成化合物的晶胞如图2所示(白球代表铜原子)。
①该晶体的化学式为_________________。
②已知铜和M的电负性分别为1.9和3.0,则铜与M形成的化合物属于_________化合物(填“离子”、“共价”)
③已知该晶体的密度为![]() g/cm3,阿伏加德罗常数的值为NA,则该晶体中Cu原子和M原子之间的最短距离为_________pm(写出计算式)。
g/cm3,阿伏加德罗常数的值为NA,则该晶体中Cu原子和M原子之间的最短距离为_________pm(写出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将物质的量均为a mol的钠和铝一同投入m g足量的水中,所得溶液的密度为ρg/cm3,则此溶液的物质的量浓度为 ( )
A.1000aρ / (50a+m) mol/L B.aρ / (46a+m) mol/L
C.1000aρ / (46a+m) mol/L D.1000aρ / (47a+m) mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将含有C、H、O的有机物3.24 g装入元素分析装置,通入足量的O2使之完全燃烧,将生成的气体依次通过CaCl2管(A)和碱石灰(B),测得A管质量增加了2.16 g,B管增加了9.24 g,已知该有机物的相对分子质量为108。
(1)燃烧此有机物3.24 g需消耗O2多少g?
(2)求此有机物的分子式。
(3)该有机物1分子中有1个苯环,试写出它的同分异构体的结构简式。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于浓硫酸特性的叙述不正确的是
A. 浓硫酸具有吸水性、脱水性和强氧化性等特性
B. 浓硫酸能吸收气体中的水蒸气,常作氨气、二氧化硫等气体的干燥剂
C. 浓硫酸可以吸收固体中的湿存水、结晶水合物中的结晶水
D. 在反应C12H22O11![]() 12C+11H2O,浓硫酸作脱水剂
12C+11H2O,浓硫酸作脱水剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、R、Q、M是六种短周期元素,原子序数依次增大。X是原子半径最小的元素,Y的气态氢化物能使湿润的红色石蕊试纸变蓝,Z为地壳中含量最多的元素,R与X同主族;Y、R、Q最外层电子数之和为8,M的单质为黄绿色有害气体。请回答下列问题:
(1)R在元素周期表中的位置为__________________。
(2)Z、Q、M简单离子半径由大到小的顺序为(写元素离子符号)_______________。
(3)X、Y、Z三种元素形成盐类化合物的水溶液呈酸性的原因:________________(用离子方程式表示)。溶液中所含离子浓度由大到小的顺序为______________。
(4)YX4M的电子式为______________,Q3Y2与水可剧烈反应,产生沉淀与气体,反应的化学方程式为_________________________________。
(5)M的单质与R的最高价氧化物对应的水化物反应的离子方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:

回答下列问题:
(1)滤渣1为_______________,操作A为_________________,向滤液②中加入双氧水的作用是___________________________________。
(2)“酸浸”后,钛主要以TiOCl42-形式存在,写出相应反应的离子方程式__________。
(3)TiO2·xH2O沉淀与双氧水、氨水反应40 min所得实验结果如下表所示:
温度/℃ | 30 | 35 | 40 | 45 | 50 |
TiO2·xH2O转化率% | 92 | 95 | 97 | 93 | 88 |
分析40℃时TiO2·xH2O转化率最高的原因_______________________________。
(4)若“滤液②”中c(Mg2+)=0.02 mol/L,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1×10-5 mol/L,此时是否有Mg3(PO4)2沉淀生成?_____________________________________________(列式计算)。FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0×10-24。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现将13.92g的MnO2与150g 36.5%盐酸(盐酸足量)共热,向反应后的溶液加入足量的硝酸银溶液,产生白色沉淀。若不考HCl的挥发,下列说法正确的是
A. 生成AgCl沉淀为0.86mol B. 转移电子数0.64NA
C. 被氧化的HCl为0.32mol D. 产生Cl2 3.584L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】周环反应是一类同时成键与断键的反应,经典的周环反应有Diels-Alder反应![]() 、电环化反应(electrocyclic reaction):
、电环化反应(electrocyclic reaction):![]() 等。
等。
已知:![]() ,其中R1、R2、R3为烷基。
,其中R1、R2、R3为烷基。
现有一种五元环状内酯I的合成路线如下(A~I均表示一种有机化合物):
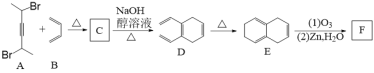
![]()
回答下列问题:
(1)化合物A中含有的官能团名称是_____________,D的分子式为________
(2)由C生成D的反应类型为_____________,A形成高聚物的结构简式为__________________
(3)由F生成G的化学方程式为____________________________________________
(4)化合物H的系统命名为_________________
(5)化合物I的质谱表明其相对分子质量为142,I的核磁共振氢谱显示为2组峰,I的结构简式为________________________
(6)在化合物I的同分异构体中能同时符合下列条件的是____________(填写结构简式)
① 具有酚结构;② 仅有一种官能团;③ 具有4种等效氢
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com