
【题目】铜及其化合物在科学研究和工业生产中具有许多用途。请回答下列问题:
(1)画出基态Cu原子的价电子排布图__________________;
(2)已知高温下Cu2O比CuO稳定,从核外电子排布角度解释高温下Cu2O更稳定的原因_________________________________________________________________________。
(3)配合物[Cu(NH3)2]OOCCH3中碳原子的杂化类型是____________,配体中提供孤对电子的原子是____________。C、N、O三元素的第一电离能由大到小的顺序是__________(用元素符号表示)。
(4)铜晶体中铜原子的堆积方式如图1所示,则晶体铜原子的堆积方式为________________。
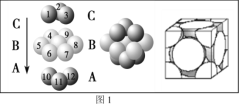
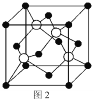
(5)M原子的价电子排布式为3s23p5,铜与M形成化合物的晶胞如图2所示(白球代表铜原子)。
①该晶体的化学式为_________________。
②已知铜和M的电负性分别为1.9和3.0,则铜与M形成的化合物属于_________化合物(填“离子”、“共价”)
③已知该晶体的密度为![]() g/cm3,阿伏加德罗常数的值为NA,则该晶体中Cu原子和M原子之间的最短距离为_________pm(写出计算式)。
g/cm3,阿伏加德罗常数的值为NA,则该晶体中Cu原子和M原子之间的最短距离为_________pm(写出计算式)。
【答案】![]() 亚铜离子核外电子处于稳定的全充满状态sp2、sp3NN > O > C面心立方最密堆积CuCl共价
亚铜离子核外电子处于稳定的全充满状态sp2、sp3NN > O > C面心立方最密堆积CuCl共价![]()
【解析】
(1)基态Cu原子的外围电子排布为:3d104s1,则基态Cu原子的价电子排布图为: ![]() ;(2)失去一个电子后,亚铜离子核外电子处于稳定的全充满状态,所以导致高温下Cu2O比CuO稳定;(3)配合物[Cu(NH3)2]OOCCH3中碳原子第一个有一个碳氧双键,其他为单键,形成的是sp2杂化,第二个碳与第一个碳和三个氢形成单键,形成的是sp3杂化;配体中N有一对孤对电子,提供孤对电子的原子是N;同周期元素的第一电离能随核电荷数的增加而增大,但N原子的2P轨道是半充满的稳定状态,所以N元素的第一电离能大于O,则C、N、O三元素的第一电离能由大到小的顺序是N>O>C; (4)铜晶体中铜原子的堆积方式如图1所示,为三层分ABA形,则晶体铜原子的堆积方式为面心立方最密堆积;(5)M原子的价电子排布式为3s23p5,M是第三周期第ⅦA族元素,即Cl,铜在晶胞占有的位置8个顶点、6个面,铜原子的个数
;(2)失去一个电子后,亚铜离子核外电子处于稳定的全充满状态,所以导致高温下Cu2O比CuO稳定;(3)配合物[Cu(NH3)2]OOCCH3中碳原子第一个有一个碳氧双键,其他为单键,形成的是sp2杂化,第二个碳与第一个碳和三个氢形成单键,形成的是sp3杂化;配体中N有一对孤对电子,提供孤对电子的原子是N;同周期元素的第一电离能随核电荷数的增加而增大,但N原子的2P轨道是半充满的稳定状态,所以N元素的第一电离能大于O,则C、N、O三元素的第一电离能由大到小的顺序是N>O>C; (4)铜晶体中铜原子的堆积方式如图1所示,为三层分ABA形,则晶体铜原子的堆积方式为面心立方最密堆积;(5)M原子的价电子排布式为3s23p5,M是第三周期第ⅦA族元素,即Cl,铜在晶胞占有的位置8个顶点、6个面,铜原子的个数 ![]() =4,Cl原子在晶胞的位置在体心,全部属于晶胞,Cl原子的个数是4,①该晶体的化学式为CuCl;②一般认为两个成键元素原子间的电负性差值大于1.7形成离子键,小于1.7形成共价键,铜与氯电负性差值3.0-1.9=1.1<1.7,该化合物属于共价化合物;③设边长为acm,
=4,Cl原子在晶胞的位置在体心,全部属于晶胞,Cl原子的个数是4,①该晶体的化学式为CuCl;②一般认为两个成键元素原子间的电负性差值大于1.7形成离子键,小于1.7形成共价键,铜与氯电负性差值3.0-1.9=1.1<1.7,该化合物属于共价化合物;③设边长为acm, ,
,![]() ,该晶胞类似于金刚石的晶胞,铜和氯最近的距离是体对角线的1/4,即距离为:
,该晶胞类似于金刚石的晶胞,铜和氯最近的距离是体对角线的1/4,即距离为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】室温下,下列叙述正确的是
A. 若V1L pH=11的NaOH溶液与V2 L pH=3的HA溶液混合后显中性,则V1≤V2
B. 等体积、等物质的量浓度的NaCl溶液中离子总数大于NaClO溶液中离子总数
C. 等体积、等物质的量浓度的Na2CO3和NaHCO3溶液混合:![]() <
<![]()
D. 将CH3COOH溶液与NaOH溶液混合,若混合后的溶液中c(CH3COO-)+c(CH3COOH)=2c(Na+),则c(OH-)+c(CH3COO-)=c(CH3COOH)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学选修3:物质结构与性质】铝、铁在生活、生产中有着广泛的用途,请回答下列问题。
(1)Fe2+的最外层电子排布式____________。元素Fe与Mn的第三电离能分别为I3(Fe)、I3(Mn),则I3(Fe)______I3(Mn)(填“>”、“<")。
(2)第四周期中,与Al原子未成对电子数相同的金属元素有____种。气态氯化铝的分子组成为(AlCl3)2,其中Al、Cl均达8e-稳定结构,Al原子的杂化方式为__________。根据等电子原理,AlO2-的空间构型为_____。
(3)Fe(CO)5的熔点为-20℃,沸点为103℃,易溶于乙醚,其晶体类型为______,晶体中σ键和π键的数目之比为______。
(4)科学家们发现某些含铁的物质可催化尿素合成肼(N2H4),沸点:N2H4>C2H6的主要原因为____________。
(5)FeO晶体的晶胞如图所示,己知:FeO晶体的密度为ρg/cm3,NA代表阿伏加德罗常数的值。在该晶胞中,与Fe2+紧邻且等距离的Fe2+数目为_____;Fe2+与O2-最短核间距为______pm(用ρ和NA表示)。
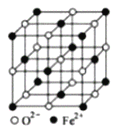
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外实验小组从煤油中取出一块钠,用滤纸吸净其表面的煤油,用切刀切下数块,分别进行实验研究:
(1)切下的钠块表面变暗,其反应的化学方程式为________________。
(2)将一小块金属钠投入水中,发生反应的离子方程式为 ____________________;可观察到的实验现象是____________(填序号)。
a.钠沉到水底 b.钠熔成小球 c.小球四处游动
(3)将其中一块钠放入坩埚中加热,反应现象为: ______________________________,反应的化学方程式是________________________。
(4)过氧化钠是钠的一种重要化合物,其中一种用途是用于呼吸面具或潜水艇中氧气的来源,涉及的主要反应的化学方程式为_______________(写一个即可),若15.6gNa2O2参加反应,则最多可制得标准状况下氧气的体积为________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数,下列说法中正确的是( )
A. 足量Fe与1molCl2完全反应,转移电子的数目为3NA
B. 22.4 L 氧气含有的分子数为NA
C. 常温常压下,28 g氮气所含的原子数为2NA
D. 0.1 mol/L的氯化铝溶液中,含有Cl的数目为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法。
I.已知反应![]() Fe2O3(s)+ CO(g)
Fe2O3(s)+ CO(g)![]()
![]() Fe(s)+ CO2(g) ΔH=-23.5 kJ·mol-1,该反应在
Fe(s)+ CO2(g) ΔH=-23.5 kJ·mol-1,该反应在
1000℃的平衡常数等于4。在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1. 0mol,反应经过l0min后达到平衡。
(1)CO的平衡转化率=____________
(2)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是________
a.提高反应温度
b.增大反应体系的压强
c.选取合适的催化剂
d.及时吸收或移出部分CO2
e.粉碎矿石,使其与平衡混合气体充分接触
Ⅱ.高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:
CO(g)+ 2H2(g)![]() CH3OH(g)。请根据图示回答下列问题:
CH3OH(g)。请根据图示回答下列问题:
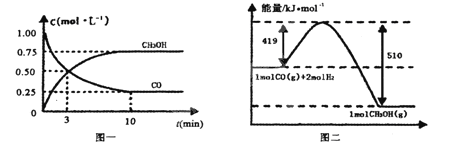
(1)从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=________
(2)若在温度和容器相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡吋的有关数据如下表:
容器 | 反应物投入的量 | 反应物的 | CH3OH的浓度 | 能量变化 |
甲 | 1mol CO和2mol H2 | α1 | c1 | 放出Q1kJ热量 |
乙 | 1mol CH3OH | α2 | c2 | 吸收Q2kJ热量 |
丙 | 2mol CO和4mol H2 | α3 | c3 | 放出Q3kJ热量 |
则下列关系正确的是________
A.c1=c2 B.2Q1=Q3 C.2α1=α3 D.α1+α2=1
E.该反应若生成1mol CH3OH,则放出(Q1+Q2)kJ热量
Ⅲ.以甲烷为燃料的新型电池,其成本大大低于以氢为燃料的传统燃料电池,目前得到广泛的研究,如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。回答下列问题:
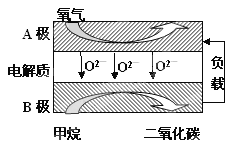
(1)B极上的电极反应式为
(2)若用该燃料电池做电源,用石墨做电极电解100mL 1mol/L的硫酸铜溶液,当两极收集到的气体体积相等时,理论上消耗的甲烷的体积为 (标况下)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组欲进行如下的实验探究金属与浓硫酸反应。试回答下列问题:
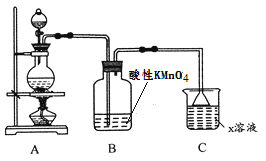
(1)利用上图装置研究铜与浓硫酸反应,反应的化学方程式为_____________________。
(2)C装置的作用___________________。
(3)将上述实验中的铜改为铁,在常温下进行,无明显现象,其原因是_______________。在加热条件下,实验的后阶段可观察到倒立的漏斗边沿有气体冒出,该气体可能为_______。
(4)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、Al2O3及不溶于强酸的SiO2)可制备Fe2O3。①用稀盐酸浸取炉渣,过滤;②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。据以上信息回答下列问题:
a.除去Al3+的离子方程式是______________________________。
b.步骤②中滤液氧化的目的是_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:有机物A的产量可以用来衡量一个国家的石油化工发展水平.现以A为主要原料合成乙酸乙酯,其合成路线如图1所示.
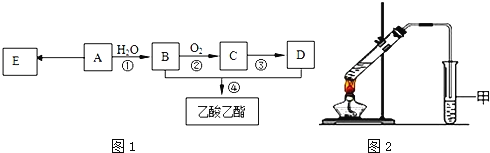
(1)A分子中官能团的名称是______,D中官能团的名称是______;反应①的反应类型是______反应.
(2)反应②的化学方程式是______,反应④的化学方程式是______.
(3)E是常见的高分子材料,合成E的化学方程式是______.
(4)某同学用如图2所示的实验装置制取少量乙酸乙酯.实验结束后,试管甲中上层为透明的、不溶于水的油状液体.
①实验开始时,试管甲中的导管不伸入液面下的目的是______.
②上述实验中饱和碳酸钠溶液的作用是(填字母)______.
A.中和乙酸和乙醇
B.中和乙酸并吸收部分乙醇
C.加速酯的生成,提高其产率
D.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时。有c(CH3COOH)+ c(CH3COO-)=0.1mol/L的醋酸、醋酸钠混合溶液,c(CH3COOH)、c(CH3COO-) 与pH的关系如图所示。下列有关溶液的叙述不正确的是。
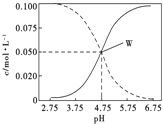
A. pH=5.5的溶液中c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)
B. 溶液中:c(H+)+ c(Na+)=c(CH3COO-)+c(OH-)
C. 由W点可以求出25℃时CH3COOH的电离常数
D. pH=4的溶液中: c(H+)+ c(Na+)+c(CH3COOH)=0.1mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com