
����Ŀ��ij����ʵ��С���ú����ȡ��һ���ƣ�����ֽ����������ú�ͣ����е��������飬�ֱ����ʵ���о���
��1�����µ��ƿ����䰵���䷴Ӧ�Ļ�ѧ����ʽΪ________________��
��2����һС�������Ͷ��ˮ�У�������Ӧ�����ӷ���ʽΪ ____________________���ɹ۲쵽��ʵ��������____________������ţ���
a���Ƴ���ˮ�� ���� b�����۳�С�� ���� c��С���Ĵ��ζ�
��3��������һ���Ʒ��������м��ȣ���Ӧ����Ϊ�� ______________________________����Ӧ�Ļ�ѧ����ʽ��________________________��
��4�������������Ƶ�һ����Ҫ���������һ����;�����ں������DZˮͧ����������Դ���漰����Ҫ��Ӧ�Ļ�ѧ����ʽΪ_______________��дһ�����ɣ�����15��6gNa2O2�μӷ�Ӧ���������Ƶñ�״�������������Ϊ________L��
���𰸡�4Na+O2=2Na2O 2 Na + 2 H2O == 2 Na++2OH- + H2�� b��c �ƿ��ۻ���ȼ������ɫ�������е���ɫ�������� 2![]() 2Na2O2+2H2O=4NaOH+O2�� �����������̼��Ӧ�ķ���ʽ�� 2��24L
2Na2O2+2H2O=4NaOH+O2�� �����������̼��Ӧ�ķ���ʽ�� 2��24L
��������
��1����������������е�������Ӧ���ɰ�ɫ�������ƣ�
��2������ˮ��Ӧ�����������ƺ���������Ӧ�Ļ�ѧ����ʽΪ2Na+2H2O=2NaOH+H2����
��3�����������£���������е�������Ӧ���ɵ���ɫ�Ĺ������ƣ�
��4��������������ˮ��������̼��Ӧ������������˿����ں������DZˮͧ����������Դ��
��1�����µ��ƿ����䰵������Ϊ��������е�������Ӧ���ɰ�ɫ�������ƣ���Ӧ�Ļ�ѧ����ʽΪ4Na+O2=2Na2O���ʴ�Ϊ��4Na+O2=2Na2O��
��2����һС�������Ͷ��ˮ�У��Ƹ���ˮ�棬���ҷ�Ӧ�������ζ������۳�һ��������С������С�������ȫ��ʧ����Ӧ�Ļ�ѧ����ʽΪ2Na+2H2O=2NaOH+H2�������ӷ���ʽΪ2Na +2H2O=2Na++2OH-+H2�����ʴ�Ϊ��2Na +2H2O=2Na++2OH-+H2����b��c��
��3��������һ���Ʒ��������м��ȣ���������е�������Ӧ���ɵ���ɫ�Ĺ������ƣ���Ӧ����Ϊ�ƿ��ۻ���ȼ�գ�������ɫ���棬�е���ɫ�������ɣ���Ӧ�Ļ�ѧ����ʽ��2Na��O2![]() Na2O2���ʴ�Ϊ��2Na��O2
Na2O2���ʴ�Ϊ��2Na��O2![]() Na2O2��
Na2O2��
��4��������������ˮ��������̼��Ӧ������������˿����ں������DZˮͧ����������Դ���漰����Ҫ��Ӧ�Ļ�ѧ����ʽΪ2Na2O2+2H2O��4NaOH+O2����2Na2O2+2CO2��
2Na2CO3+O2��15.6gNa2O2��0.2mol�������Ƶñ�״�������������Ϊ0.1mol��22.4
L/mol��2.24L���ʴ�Ϊ��2Na2O2+2H2O��4NaOH+O2����2Na2O2+2CO2��2Na2CO3+O2��2.24L��


 �������Ͽ��㱾ϵ�д�
�������Ͽ��㱾ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���й����ʵ�ת����ϵ��ͼ��ʾ(��Ӧ���������ֲ�������ȥ)��A��C��D�о�������ͬ�ķǽ���Ԫ�أ�C��GΪ���壬DΪ����ɫ���ʣ�IΪ����ǿ�ᣬ��Ӧ��Ϊ���Ϸ�Ӧ��J��Һ��KSCN��Һ��ϳ�Ѫ��ɫ��A�н�������Ԫ�أ���Ԫ��������Ϊ7��8��

��ش���������:
(1)A�Ļ�ѧʽΪ__________��
(2)H�ĵ���ʽΪ__________��
(3)д���ٵ����ӷ���ʽΪ__________��
(4)д���ڵĻ�ѧ����ʽΪ____________���õ����ű������ת�Ʒ������Ŀ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����.��������Ҫ�Ļ�ѧ�Լ�������ԭ�Ϻ��й�����չǰ��������Դ���Լ״�Ϊԭ���Ʊ�������һ��ԭ������:
i. CH3OH(g) ![]() CO(g)+ 2H2��g�� ��H =+90kJ��mol-1
CO(g)+ 2H2��g�� ��H =+90kJ��mol-1
ii. CO(g)+H2O(g)![]() CO2(g)+ H2(g) ��H =-41kJ��mol-1
CO2(g)+ H2(g) ��H =-41kJ��mol-1
(1)��VL �����ܱ������г���lmol CH3OH(g),������Ӧi��ͼI������ȷ��ʾCHOH(g)��ƽ��ת����(a)���¶�(T) �仯��ϵ������Ϊ_______________(�A����B��)��T1��ʱ����ϵ��ƽ��ѹǿ����ʼѹǿ֮��Ϊ_________________________��

��2����ʼ��10L �����ܱ������г���lmol CH3OH(g)��1molH2O(g)��������Ӧi�ͷ�Ӧii����ϵ��CO��ƽ������������¶�(T)��ѹǿ(P)�Ĺ�ϵ��ͼ2��ʾ��
��P1��P2��P3�ɴ�С��˳��Ϊ___________________��
�ڲ��C��ʱ����ϵ��CO2�����ʵ���Ϊ0.2mol����T2��ʱ����Ӧii ��ƽ�ⳣ��K=________��
��.����HA��HB ��H2C�����ᡣ��������0.1mol��L-1NaOH��Һ�ֱ�ζ�20.00 mLŨ�Ⱦ�Ϊ0.1mol��L-1��HA��HB���������Һ���ζ���������Һ��pH������NaOH ��Һ����ı仯��ͼ��ʾ��
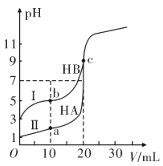
��1��a��ʱ����Һ����ˮ�������c(H+)=________mol��L-1��
��2��������I �ϵ�c���Ӧ����Һ�и�����Ũ���ɴ�С��˳��Ϊ_____________________________��
��3����֪��������0.1mol��L-1��NaHC ��Һ�е��뼸��ʯ����Һ����Һ��ɺ�ɫ��
�� ����ô���Һ��pH=1����NaHC�ĵ��뷽��ʽΪ_______________��
�����ڴ���Һ���ܼ�H2C ���ӣ������Һ��c(C2-)________c(H2C)(�>����<����=��)��
����H2C ��һ������ΪH2C=H++ HC-��������0.1mol��L-1H2C��Һ�е�c(H+ )=0.11mol��L-1����0.1mol��L-1NaHC��Һ�е�c(H+)________0.01mol��L-1(�>����<����=��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NaHCO3��֪ʶ��ա�
��1��NaHCO3����_________��
��2��NaHCO3ˮ��Һ�е����̪����Һ��_________ɫ��
��3��NaHCO3�����ᷴӦ�����ӷ���ʽ__________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����50 mL 18 mol��L��1��H2SO4��Һ�м���������ͭƬ�����ȡ���ַ�Ӧ����ԭ��H2SO4�����ʵ����� ��
A. ��0.45 mol B. ����0.45 mol
C. ��0.45��0.90 mol֮�� D. ����0.45 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ը����Ϊԭ�ϣ��绯ѧ���Ʊ��ظ���ص�ʵ��װ��ʾ��ͼ���£�����˵������ȷ����( )

A. �������ң������ĵ缫��ӦΪ2H2O��2e��=2OH����H2��
B. �������ң�ͨ�����Һ���ɻ�ɫ��Ϊ��ɫ������Ϊ������H��Ũ������ʹƽ��2CrO��2H��![]() Cr2O��H2O�����ƶ�
Cr2O��H2O�����ƶ�
C. ���Ʊ��������ܷ�Ӧ�Ļ�ѧ����ʽΪ4K2CrO4��4H2O=2K2Cr2O7��4KOH��2H2����O2��
D. �ⶨ����Һ��K��Cr�ĺ�������K��Cr�����ʵ���֮��(nK/nCr)Ϊd�����ʱ����ص�ת����Ϊ1��d
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͭ���仯�����ڿ�ѧ�о���ҵ�����о���������;����ش��������⣺
��1��������̬Cuԭ�ӵļ۵����Ų�ͼ__________________��
��2����֪������Cu2O��CuO�ȶ����Ӻ�������Ų��ǶȽ�������Cu2O���ȶ���ԭ��_________________________________________________________________________��
��3�������[Cu(NH3)2]OOCCH3��̼ԭ�ӵ��ӻ�������____________���������ṩ�¶Ե��ӵ�ԭ����____________��C��N��O��Ԫ�صĵ�һ�������ɴ�С��˳����__________����Ԫ�ط��ű�ʾ����
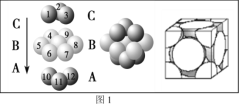
��4��ͭ������ͭԭ�ӵĶѻ���ʽ��ͼ1��ʾ������ͭԭ�ӵĶѻ���ʽΪ________________��
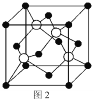
��5��Mԭ�ӵļ۵����Ų�ʽΪ3s23p5��ͭ��M�γɻ�����ľ�����ͼ2��ʾ���������ͭԭ�ӣ���
�ٸþ���Ļ�ѧʽΪ_________________��
����֪ͭ��M�ĵ縺�Էֱ�Ϊ1.9��3.0����ͭ��M�γɵĻ���������_________���������ӡ��������ۡ���
����֪�þ�����ܶ�Ϊ![]() g/cm3�������ӵ�������ֵΪNA����þ�����Cuԭ�Ӻ�Mԭ��֮�����̾���Ϊ_________pm��д������ʽ����
g/cm3�������ӵ�������ֵΪNA����þ�����Cuԭ�Ӻ�Mԭ��֮�����̾���Ϊ_________pm��д������ʽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ij����ij�տ��������������ݣ�����������ȷ����

A. ���տ�����Ҫ��Ⱦ����PM2.5
B. ���տ��������ȼ�������
C. ��Ⱦ��NO2��CO������Ҫ��Դ�ڻ�����β��
D. PM2.5��PM10ָ�����������������Ӱ�����彡��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������C��H��O���л���3.24 gװ��Ԫ�ط���װ�ã�ͨ��������O2ʹ֮��ȫȼ�գ������ɵ���������ͨ��CaCl2��(A)�ͼ�ʯ��(B)�����A������������2.16 g��B��������9.24 g����֪���л������Է�������Ϊ108��
(1)ȼ�մ��л���3.24 g������O2����g��
(2)����л���ķ���ʽ��
(3)���л���1��������1����������д������ͬ���칹��Ľṹ��ʽ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com