
【题目】下列关于浓硫酸特性的叙述不正确的是
A. 浓硫酸具有吸水性、脱水性和强氧化性等特性
B. 浓硫酸能吸收气体中的水蒸气,常作氨气、二氧化硫等气体的干燥剂
C. 浓硫酸可以吸收固体中的湿存水、结晶水合物中的结晶水
D. 在反应C12H22O11![]() 12C+11H2O,浓硫酸作脱水剂
12C+11H2O,浓硫酸作脱水剂
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数,下列说法中正确的是( )
A. 足量Fe与1molCl2完全反应,转移电子的数目为3NA
B. 22.4 L 氧气含有的分子数为NA
C. 常温常压下,28 g氮气所含的原子数为2NA
D. 0.1 mol/L的氯化铝溶液中,含有Cl的数目为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼(B)、铝(Al)、镓(Ga)均属于硼族元素(第ⅢA族),它们的化合物或单质都有重要用途。回答下列问题:
(1)写出基态镓原子的电子排布式____________。
(2)已知:无水氯化铝在178℃升华,它的蒸气是缔合的双分于(Al2Cl6),更高温度下Al2Cl6则离解生成A1Cl3单分子。
①固体氯化铝的晶体类型是______________;
②写出Al2Cl6分子的结构式_______________;
③单分子A1Cl3的立体构型是__________,缔合双分子Al2Cl6中Al原子的轨道杂化类型是_______。
(3)晶体硼的结构单元是正二十面体,每个单元中有12个硼原子(如图),若其中有两个原子为10B,其余为11B,则该结构单元有____________种不同的结构类型。

(4)金属铝属立方晶系,其晶胞边长为405 pm,密度是2.70g·cm3,计算确定其晶胞的类型(简单、体心或面心立方)________________;晶胞中距离最近的铝原子可看作是接触的,列式计算铝的原子半径r(A1)=______________pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2是国内外允许使用的一种食品添加剂,在食品工业中发挥着护色、防腐、漂白和抗氧化的作用。我国对于SO2的添加量有明确规定(如图所示)。

某研究小组用图装置对市售黄花菜中的SO2进行测定。其中,溶液X为黄花菜进行充分浸泡后所得浅黄色浸泡液,Y为加入的试剂。(Y的浓度及体积均未标出)查阅资料发现,在水溶液中正四价硫元素主要以SO32-形式存在,且SO2与SO32-化学性质相似。因此,该小组同学将SO2的测定问题转化为溶液中SO32-的测定。
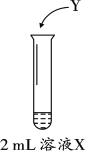
(1)结合化学知识解释浸泡液X中存在SO32-的原因是______。
(2)甲同学预测可用Na2S溶液验证X中是否含有SO32-,该预测应用的是Na2S的______性。查阅资料发现该反应较为复杂,因此未做进一步验证。
(3)乙同学为验证X中是否含有SO32-,进行了实验i:
实验序号 | 试剂Y | 现象 |
i | 酸性KMnO4溶液 | ① |
根据实验i 的现象得出结论:X中含有SO32-。实验i的现象是________,SO32-在反应后转化为_________。
(4)丙同学认为也可以用H2O2溶液来验证X中是否含有SO32-,进行了实验ii:
实验序号 | 操作 | 现象 |
ii | a.向X中加入适量H2O2溶液,振荡 | 无明显现象 |
b.继续滴加 ,振荡 | 无明显现象 | |
c.再滴加 ,振荡 | 白色沉淀 |
通过实验ii可证明X中含有SO32-,写出操作b、c中滴加试剂的化学式____、 _____ 。
(5)丁同学认为丙的实验方案不严谨,设计了对比实验ⅲ,证明了X中含有SO32-。实验ⅲ的方案是(从操作、现象、结论方面描述)________ 。
(6)为测定市售黄花菜中SO2含量,进行实验ⅳ:
实验序号 | 操作 |
ⅳ | a.将50克黄花菜研碎,用一定浓度氢氧化钠溶液浸泡; b.加稀硫酸酸化; c.加入淀粉指示剂; d.用浓度为0.01mol/L的I2溶液滴定,消耗0.01mol/L的I2溶液5.00 mL。 |
查阅资料发现:碘元素的常见价态有-1,0,+1,+3,+5,+7。
① 将黄花菜用氢氧化钠溶液浸泡的目的是(用化学方程式表示)__________。
② 写出滴定反应的化学方程式____________。
③ 该市售黄花菜中SO2残留量是________毫克/千克。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向50 mL 18 mol·L-1的H2SO4溶液中加入适量的铜片并加热。充分反应后,被还原的H2SO4的物质的量( )
A. 小于0.45 mol B. 等于0.45 mol
C. 在0.45~0.90 mol之间 D. 大于0.45 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时。有c(CH3COOH)+ c(CH3COO-)=0.1mol/L的醋酸、醋酸钠混合溶液,c(CH3COOH)、c(CH3COO-) 与pH的关系如图所示。下列有关溶液的叙述不正确的是。
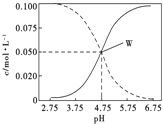
A. pH=5.5的溶液中c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)
B. 溶液中:c(H+)+ c(Na+)=c(CH3COO-)+c(OH-)
C. 由W点可以求出25℃时CH3COOH的电离常数
D. pH=4的溶液中: c(H+)+ c(Na+)+c(CH3COOH)=0.1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是一种理想的“绿色能源”,利用氢能需要选择合适的储氢材料。目前正在研究和使用的储氢材料有镁系合金、稀土系合金等。
(1)已知,Mg(s) +H2(g)==MgH2(s) △H=-74.5kJ/mol
Mg2Ni(s) + 2H2(g)==Mg2NiH4(s) △H=-64.4kJ/mol
MgNi(s)+ 2MgH2(s)==2Mg(s)+ Mg2NiH4(s) △H=____kJ/mol。
(2)储氢材料Mg(AlH4)2在110~200℃的反应为:Mg(AlH4)2==MgH2+2Al+3H2↑。反应中每转移3mol电子时,产生的H2在标准状况下的体积为_____________L。
(3)镧镍合金在一定条件下可吸收氢气形成氢化物:LaNi5(s)+3H2(g) ![]() LaNi5H6(s) △H<0,欲使LaNi5H6(s)释放出气态氢,根据平衡移动原理,可改变的条件是_________(填字母编号)。
LaNi5H6(s) △H<0,欲使LaNi5H6(s)释放出气态氢,根据平衡移动原理,可改变的条件是_________(填字母编号)。
a.增加LaNi5H6(s)的量 b.升高温度 c.减小压强 d.使用催化剂
(4)储氢还可借助有机物,如利用环己烷和苯之间的可逆反应来实现脱氢和加氢:![]()
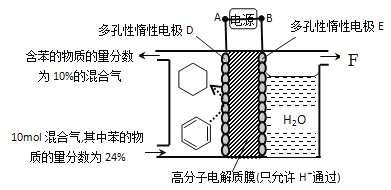
①某温度下,向恒容密闭容器中加入环己烷,起始浓度为amol·L-1,平衡时苯的浓度为b mol·L-1,该反应的平衡常数K=_____________(用含a、b的代数式表示)。
②一定条件下,下图装置可实现有机物的电化学储氢(忽略其它有机物)。A是电源的__________极(填“正”或“负”);电解过程中产生的气体F为________(填化学式):电极D上发生的电极反应为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下面的反应路线及所给信息填空。

(1)A的结构简式是 ,名称是 。
(2)①的反应类型是 ,③的反应类型是 。
(3)反应④ 的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒和碲在工业上有重要用途。在铜、镍、铅等电解工艺的阳极泥中硒、碲主要以硒化物、碲化物及金属状态存在。一种从阳极泥中提取Se和Te的工艺流程见下:
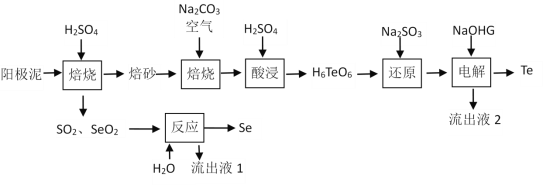
已知:碲酸钠(Na2H4TeO6)难溶,碲酸(H6TeO6)可溶。
回答下列问题:
(1)阳极泥在600 K左右加入一定浓度H2SO4“焙烧”时,单质Te转化为TeO2的化学方程式为___________________________________________。
(2) “焙砂”与碳酸钠充分混合,干燥后通空气氧化物料,每生成1 mol碲酸钠,则需要的氧化剂O2至少为_______mol;生成的碲酸钠不水浸,而采取“酸浸”的原因是______________________________________。
(3) “反应”时的化学方程式为_________________________________________________。
(4)“还原”中的反应生成物为TeO2,检验反应后是否有反应物Na2SO3过量的实验操作方法为________________________________________________________。
(5)已知“电解”时使用石墨电极,阳极产物与阴极产物的物质的量之比为______________。
(6)工艺路线中可以循环利用的物质有_____________________、_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com