
【题目】下列实验不合理的是
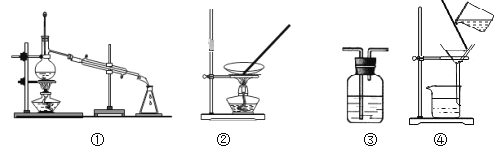
A. 用浓硫酸干燥SO2,选③
B. 从食盐溶液中获取NaCl,选②
C. 除去自来水中的Cl-,制纯净水,选④和①
D. 除去Fe(OH)3胶体中的难溶物,选④
科目:高中化学 来源: 题型:
【题目】结合某城市某日空气质量报告内容,以下叙述正确的是

A. 该日空气首要污染物是PM2.5
B. 该日空气质量等级属于优
C. 污染物NO2、CO可能主要来源于机动车尾气
D. PM2.5、PM10指的是悬浮颗粒物,不会影响人体健康
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将含有C、H、O的有机物3.24 g装入元素分析装置,通入足量的O2使之完全燃烧,将生成的气体依次通过CaCl2管(A)和碱石灰(B),测得A管质量增加了2.16 g,B管增加了9.24 g,已知该有机物的相对分子质量为108。
(1)燃烧此有机物3.24 g需消耗O2多少g?
(2)求此有机物的分子式。
(3)该有机物1分子中有1个苯环,试写出它的同分异构体的结构简式。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、R、Q、M是六种短周期元素,原子序数依次增大。X是原子半径最小的元素,Y的气态氢化物能使湿润的红色石蕊试纸变蓝,Z为地壳中含量最多的元素,R与X同主族;Y、R、Q最外层电子数之和为8,M的单质为黄绿色有害气体。请回答下列问题:
(1)R在元素周期表中的位置为__________________。
(2)Z、Q、M简单离子半径由大到小的顺序为(写元素离子符号)_______________。
(3)X、Y、Z三种元素形成盐类化合物的水溶液呈酸性的原因:________________(用离子方程式表示)。溶液中所含离子浓度由大到小的顺序为______________。
(4)YX4M的电子式为______________,Q3Y2与水可剧烈反应,产生沉淀与气体,反应的化学方程式为_________________________________。
(5)M的单质与R的最高价氧化物对应的水化物反应的离子方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:

回答下列问题:
(1)滤渣1为_______________,操作A为_________________,向滤液②中加入双氧水的作用是___________________________________。
(2)“酸浸”后,钛主要以TiOCl42-形式存在,写出相应反应的离子方程式__________。
(3)TiO2·xH2O沉淀与双氧水、氨水反应40 min所得实验结果如下表所示:
温度/℃ | 30 | 35 | 40 | 45 | 50 |
TiO2·xH2O转化率% | 92 | 95 | 97 | 93 | 88 |
分析40℃时TiO2·xH2O转化率最高的原因_______________________________。
(4)若“滤液②”中c(Mg2+)=0.02 mol/L,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1×10-5 mol/L,此时是否有Mg3(PO4)2沉淀生成?_____________________________________________(列式计算)。FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0×10-24。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、KClO3和浓盐酸在一定温度下反应,还原产物为黄绿色的易爆物二氧化氯。其变化可以表示为:□KClO3+□HCl(浓)→□KCl+□ClO2↑+□Cl2↑+□H2O+□__________
(1)请配平该化学方程式_____________________________________。
(2)浓盐酸在反应中显示出来的性质是______________________________(填编号)。
①只有还原性②还原性和酸性③只有氧化性④氧化性和酸性
Ⅱ、已知反应:2H2CrO4+3H2O2=2Cr(OH)3↑+2H2O该反应中H2O2只发生如下变化过程H2O2→H2O
(1)该反应中的还原剂是__________________________。
(2)该反应中被还原的元素是_______________,还原产物是_____________________。
(3)若产生的气体在标准状况下体积为3.36L,则反应中转移了_________mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现将13.92g的MnO2与150g 36.5%盐酸(盐酸足量)共热,向反应后的溶液加入足量的硝酸银溶液,产生白色沉淀。若不考HCl的挥发,下列说法正确的是
A. 生成AgCl沉淀为0.86mol B. 转移电子数0.64NA
C. 被氧化的HCl为0.32mol D. 产生Cl2 3.584L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取一定质量NaHCO3和Na2O的固体混合物溶于适量的水,将所得溶液分成两等份,向其中一份水溶液中缓慢逐滴加入某物质的量浓度的盐酸,产生的气体体积与所加盐酸体积之间的关系如图所示;向另一份水溶液中加入过量Ba(OH)2溶液,得到白色沉淀39.4g。试回答下列问题:

(1)盐酸的物质的量浓度为___________;
(2)固体混合物中NaHCO3与Na2O物质的量之比_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种常见的金属单质,A在空气中燃烧生成淡黄色固体;B为红色固体,锈蚀时变为绿色;C在空气中加热熔化但不滴落;D在氧气中燃烧,火星四射。
根据以上信息回答下列问题:
(1)写出对应化学式:A______,B______,C______,D______。
(2)A在室温下与氧气反应时生成__________(写化学式,下同),D在空气中锈蚀生成__________。
(3)写出下列化学方程式:
①A在空气中燃烧______________________;
②B与氧气在加热条件下反应______________________;
③C在氧气中燃烧________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com