
【题目】下列实验现象与对应化学方程式都正确的是( )
A. 钠投入水中,浮在水面熔成小球,在水面快速移动,得到的溶液显碱性;2 Na + 2 H2O ![]() 2 NaOH + H2↑
2 NaOH + H2↑
B. 氢气在氯气中安静的燃烧,发出淡蓝色火焰,瓶口出现白雾;H2 + Cl2 ![]() 2HCl
2HCl
C. FeSO4溶液中加入NaOH溶液时,生成的白色絮状沉淀迅速变为灰绿色,最后变成红褐色; 2Fe(OH)2 + O2 + H2O ![]() 2 Fe(OH)3
2 Fe(OH)3
D. 向Na2SiO3溶液中逐滴加入稀盐酸,边加边振荡,有硅酸胶体产生;Na2SiO3 + 2HCl ![]() H2SiO3+ 2NaCl
H2SiO3+ 2NaCl
【答案】A
【解析】
A.金属钠投入水中,浮在水面熔成小球,并在水面快速移动,得到的溶液显碱性,化学反应方程式为:2Na+2H2O═2NaOH+H2↑,选项A正确;
B.氢气在氯气中安静的燃烧,发出苍白色的火焰,瓶口出现白雾,反应为H2+Cl2![]() 2HCl,选项B错误;
2HCl,选项B错误;
C. FeSO4溶液中加入NaOH溶液时,生成的白色絮状沉淀迅速变为灰绿色,最后变成红褐色的氢氧化铁,反应的化学方程式为4Fe(OH)2 +O2 +2H2O ![]() 4Fe(OH)3,选项C错误;
4Fe(OH)3,选项C错误;
D. 向Na2SiO3溶液中逐滴加入稀盐酸,边加边振荡,有硅酸胶体产生;Na2SiO3 + 2HCl ![]() H2SiO3(胶体)+ 2NaCl,选项D错误。
H2SiO3(胶体)+ 2NaCl,选项D错误。
答案选A。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】金属及其化合物的种类很多,我们可以按照“金属单质、金属氧化物、金属氢氧化物、盐”的类别进行研究。以下是元素周期表中前18号某种金属元素对应的单质及其化合物之间的转化关系(“→”所指的转化都是一步完成)。
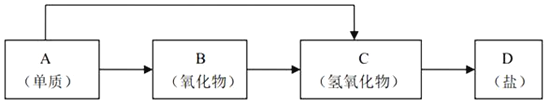
(1)若B为呼吸面具中的供氧剂,其供氧时每生成1molO2,反应过程中转移的电子数为___________________,A与水反应的离子方程式为:_____________________。
(2)200℃时,11.6g CO2和H2O的混合物气体与足量的B反应,反应后固体增加了3.6g,则原混合物的平均相对分子质量为______________。
(3)写出一种“C→D”转化的离子方程式:___________________________________。
(4)某同学将一小块A单质露置于空气中,观察到下列现象:
银白色![]() 变灰暗
变灰暗![]() 变白色
变白色![]() 出现液滴
出现液滴![]() 白色固体
白色固体
则下列说法正确的是_____________________。
A.①发生了氧化还原反应
B.①变灰暗色是因为生成了过氧化钠
C.③是碳酸钠吸收空气中的水蒸气形成了溶液
D.④只发生物理变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识填写下列空白。
(1)已知拆开1mol H-H键,1mol N-H键,1mol N≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成1mol NH3的反应热ΔH =__________________。
(2)氢气的燃烧热为286kJ/mol。写出表示氢气燃烧热的热化学方程式____________________________________________。
(3)某温度下纯水中的c(H+) = 1×10-6.5mol/L。若温度不变,滴入稀硫酸使c(H+)= 5×10-5mol/L,则由水电离出的c(H+) =__________mol/L。
(4)已知在第(3)问条件下,盐酸的pH=a,氢氧化钡的pH=b。若酸碱按体积比1:10混合后溶液显中性,则a+b=_________。
(5)某二元酸(化学式用H2B表示)在水中的电离方程式是H2B=H++HB-, HB- ![]() H++B2-。
H++B2-。
已知0.1 mol/L NaHB溶液的pH=2,则0.1 mol/L H2B溶液中c(H+)小于0.11 mol/L的原因是____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有失去标签的甲、乙、丙、丁四瓶溶液,它们分別是Ba(NO3)2、H2SO4、Na2SO4、K2CO3的一种,为了鉴别他们,进行了如下实验:
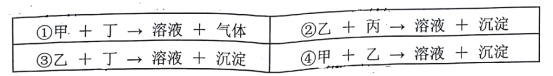
在④得到的沉淀中加入足量稀盐酸,沉淀迅速溶解,并产生无色无味的气体。
根据以上实验事实,回答下列问题:
(1)从④得到沉淀所使用的玻璃仪器有__________________________。
(2)乙、丁的名称分别是:乙_______________,丁_____________。
(3)请写出在④得到的沉淀中加入足量稀盐酸的离子反应方程式__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼镁泥是硼镁矿生产硼砂晶体(Na2B4O7·10H2O)时的废渣,其主要成分是MgO,还含有Na2B4O7、CaO、Fe2O3、FeO、MnO、SiO2等杂质。以硼镁泥为原料制取七水硫酸镁的工艺流程如下:

回答下列问题:
(l)Na2B4O7·10H2O中B的化合价为__________。
(2)Na2B4O7易溶于水,也易发生水解:B4O72-+7H2O![]() 4H3BO3(硼酸)+2OH-(硼酸在常温下溶解度较小)。写出加入硫酸时Na2B4O7发生反应的化学方程式:______________。
4H3BO3(硼酸)+2OH-(硼酸在常温下溶解度较小)。写出加入硫酸时Na2B4O7发生反应的化学方程式:______________。
(3)滤渣B中含有不溶于稀盐酸但能溶于热浓盐酸的黑色固体,写出生成黑色固体的离子方程式____________。
(4)加入MgO的目的是___________________。
(5)已知MgSO4、CaSO4的溶解度如下表:
温度(℃) 溶解度(g) | 40 | 50 | 60 | 70 |
MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
“操作A”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明“操作A”步骤为____________________。
(6)硼砂也能在工业上制取NaBH4,NaBH4被称为有机化学中的“万能还原剂”。
①写出NaBH4的电子式:___________。
②“有效氢含量”可用来衡量含氢还原剂的还原能力,其定义是:每克含氢还原剂的还原能力相当于多少克H2的还原能力。NaBH4的有效氢含量为_________(保留两位小数)。
③在碱性条件下,在阴极上电解NaBO2也可制得硼氢化钠,写出阴极室的电极反应式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,两瓶体积相等的气体,在同温同压时瓶内气体(N2O和CO2不发生化学反应)的关系不正确的是
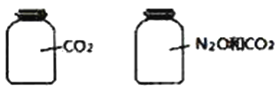
A. 所含氧原子数相等 B. 气体的总质量相等
C. 气体所含电子总数相等 D. 气体的密度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸合铁酸钾晶体Kx[Fe(C2O4)y]·3H2O 是一种光敏材料,见光易分解,下面是一种制备草酸合铁酸钾晶体的实验流程。
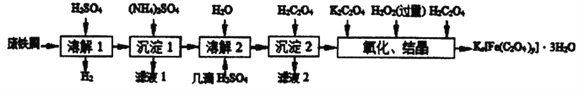
已知:(NH4)SO4、FeSO4·7H2O、莫尔盐[(NH4)2SO4·FeSO4·6H2O]的溶解度如表:
温度/℃ | 10 | 20 | 30 | 40 | 50 |
(NH4)SO4/g | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 |
FeSO4·7H2O/g | 40.0 | 48.0 | 60.0 | 73.3 | — |
(NH4)2SO4·FeSO4·6H2O/g | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 |
(1)废铁屑在进行“溶解1”前,得用在5%Na2CO3溶液中加热数分钟,并洗涤干净.Na2CO3溶液的作用是___________________。
(2)“复分解”制备莫尔盐晶体的基本实验步骤是: 蒸发浓缩、_________、过滤、用乙醇洗涤、干燥。用乙醇洗涤的目的是_________ 。
(3)“沉淀2"时得到的FeC2O4·2H2O 沉淀需用水洗涤干净.检验沉淀是否洗涤干净的方法是_____。
(4)“结晶”时应将溶液放在黑暗处等待晶体的析出,这样操作的原因是_________ 。
(5)为测定该晶体中铁的含量,某实验小组做了如下实验:
步骤1: 准确称量5.00g 草酸合铁酸钾晶体,配制成250mL 溶液
步骤2:取所配溶液25.00 mL于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部氧化成二氧化碳,同时,MnO4-被还原成Mn2+。向反应后的溶液中加入一小匙锌粉,加热至黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍呈酸性。
步骤3:用0.010mol/L KMnO4溶液滴定步骤2所得溶液至终点,消耗KMnO4溶液20.02mL,滴定中MnO4-被还原成Mn2+.重复步骤2、步骤3 操作,滴定消耗 0.010mol/LKMnO4溶液19.98mL,实验测得该晶体中铁的质量分数为_____ (写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有常见的A~J物质存在如下转化关系示意图(反应条件已略去),已知通常情况下A为固态金属单质,B、D为气态非金属单质,E为淡黄色固体,F为无色液体,J为红褐色沉淀。请回答下列问题:
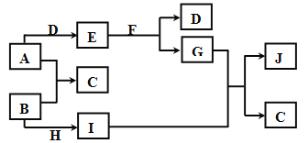
(1)写出下列物质的化学式:H________;D__________。
(2)写出下列转化的化学方程式或离子方程式:
①E+F→D+G的化学方程式:__________________________________;
②G+I→C+J的离子方程式:_________________________________。
(3)若要检验I物质的阳离子所加入的试剂是________________________。实验现象为:_______________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com