
【题目】已知硫酸铜加热分解生成CuO、O2、SO2和SO3(g)。通过测定产生的三种气体的量可确定该反应的方程式。实验用到的仪器如下图所示。

有关操作和结果如下(已知:H++HSO3-=SO2↑+H2O)。
①准确称取一定质量的无水CuSO4固体充分加热到完全分解。
②实验后测得装置F总质量比实验前减少了0.96 g(忽略水蒸气的损失和SO2的溶解)。
③干燥管C在实验后质量增加3.84 g。
④由量筒中水的体积,折算出标准状况下相应气体的体积为224 mL。
试回答下列问题:
(1)装置C的作用是__________________,装置F的作用是______________。
(2)使用上图所给仪器装置(可重复使用),按从左到右的方向连接各仪器,接口顺序为①→⑨⑩→⑥⑤→________→________→________→②(填序号) 。
(3)装置F中发生反应的化学方程式为_______________________________________。
(4)请通过计算,推断出该条件下反应的化学方程式为_________________________。
【答案】吸收SO2吸收SO3③④ ⑥⑤(或③④) ⑧⑦SO3(g)+2NaHSO3=Na2SO4+2SO2+H2O(或SO3+H2O=H2SO4、H2SO4+2NaHSO3=Na2SO4+2SO2↑+2H2O)4CuSO4![]() 4CuO+2SO3↑+2SO2↑+O2↑
4CuO+2SO3↑+2SO2↑+O2↑
【解析】
(1)硫酸铜加热分解生成CuO、O2、SO2和SO3气体,根据题中提供的装置和药品可知,实验中用亚硫酸氢钠能吸收三氧化硫,用碱石灰吸收二氧化硫,所以装置C的作用是吸收二氧化硫,装置F的作用是吸收三氧化硫;
(2)气体的制备和收集按照发生装置→除杂装置→干燥气体→气体吸收装置→排水→测量装置来安装实验仪器,按从左至右的方向,先制备气体,通过亚硫酸氢钠吸收三氧化硫,再通过浓硫酸干燥二氧化硫气体和氧气,通过碱石灰吸收二氧化硫称量计算,为防止E中的水蒸气进入C装置,在C后面再连一个D装置,最后利用排水量气法测定氧气的体积,各仪器接口连接顺序为①⑨⑩⑥⑤③④⑥⑤⑧⑦②;
(3)三氧化硫与亚硫酸氢钠溶液反应生成硫酸钠和二氧化硫,反应方程式为SO3(g)+2NaHSO3=Na2SO4+2SO2+H2O或SO3+H2O=H2SO4、H2SO4+2NaHSO3=Na2SO4+2SO2↑+2H2O;
(4)实验后测得装置F总质量比实验前减少了0.96g,根据方程式SO3(g)+2NaHSO3=Na2SO4+2SO2+H2O可知,F中吸收的三氧化硫的物质的量为0.96/(64×2-80) mol=0.02mol,同是产生二氧化硫的物质的量为0.04mol,干燥管C吸收的物质是二氧化硫,二氧化硫包括硫酸铜分解生成的二氧化硫以及三氧化硫和水、亚硫酸氢钠反应生成的二氧化硫,二氧化硫的物质的量是3.84g÷64g/mol=0.06mol,所以原分解反应中生成的二氧化硫的物质的量为0.06mol-0.04mol=0.02mol;测得量筒B中水的体积,得出气体在标准状况下的体积为224mL,该气体是氧气,其物质的量是0.224L÷22.4L/mol=0.01mol,根据硫酸铜中铜元素与硫元素的关系可知,硫酸铜的物质的量为0.02mol+0.02mol=0.04mol,根据铜元素守恒可知,生成的氧化铜的物质的量为0.04mol,所以n(CuSO4):n(CuO):n(SO2):n(SO3):n(O2)=0.04mol:0.04mol:0.02mol:0.02mol:0.01mol=4:4:2:2:1,所以其分解方程式为4CuSO4![]() 4CuO+2SO3↑+2SO2↑+O2↑。
4CuO+2SO3↑+2SO2↑+O2↑。


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:
【题目】在四个恒容密闭容器中按左下表相应量充入气体,发生反应2N2O(g)![]() 2N2(g)+O2(g),容器Ⅰ、Ⅱ、Ⅲ中N2O的平衡转化率如下图所示:
2N2(g)+O2(g),容器Ⅰ、Ⅱ、Ⅲ中N2O的平衡转化率如下图所示:
容器 | 容积/L | 起始物质的量/mol | ||
N2O | N2 | O2 | ||
Ⅰ | V1 | 0.1 | 0 | 0 |
Ⅱ | 1.0 | 0.1 | 0 | 0 |
Ⅲ | V3 | 0.1 | 0 | 0 |
Ⅳ | 1.0 | 0.06 | 0.06 | 0.04 |
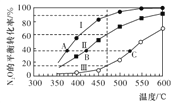
下列说法正确的是
A. 该反应的正反应放热
B. 相同温度下反应相同时间,平均反应速率:v(Ⅰ)>v(Ⅱ)
C. 容器Ⅳ在470℃进行反应时,起始反应速率:v正(N2O)<v逆(N2O)
D. 图中A、B、C三点处容器内总压强:pA(I)< pB(Ⅱ)<pC(Ⅲ)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 向新制氯水中加入少量CaCO3粉末后,溶液的pH减小
B. SO2、氯气都能使品红溶液褪色,但原理不同
C. NaHCO3、CH3COONH4都能分别和盐酸、烧碱溶液反应
D. FeSO4溶液、Na2SO3溶液在空气中都易因氧化而变质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验的说法正确的是( )

A. 图A中测定锌粒与1 mol/L稀硫酸反应速率,只需测定注射器中收集氢气的体积
B. 图B装置中进行50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液测定中和热,使温度计温度升高的热量就是中和反应生成1 mol水的热量
C. 图C酸碱中和滴定中,可以在滴定过程中用少量水冲洗锥形瓶内壁以减小实验误差
D. 图D滴定管中读数为26.50mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某试剂瓶上贴有如下标签,对该试剂理解正确的是
![]()
A. 该溶液中含有的微粒主要有:NaCl、Na+、Cl-、H2O
B. 若取50毫升溶液,其中的c(Cl-)=0.05 mol/L
C. 若取该溶液与0.1 mol/L AgNO3 100 mL溶液完全反应,需要取该溶液10 mL
D. 该溶液与1.0mol/LNa2SO4溶液的c(Na+)相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 用盐酸标准溶液测定NaOH溶液浓度滴定实验中,滴定前无气泡而滴定后有气泡,会使测定值偏高
B. 将地下钢管与直流电源的正极相连,用来保护钢管
C. 已知在101KPa下,1gH2燃烧生成水蒸气放出121kJ热量,其热化学方程式为:2H2(g)+O2(g)=2H2O(g)△H=-484kJ·mol-1
D. 25℃,101kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3kJ·mol-1,表示稀H2SO4与KOH溶液反应的中和热的热化学方程式为:H2SO4(aq)+2KOH(aq)=K2SO4(aq)+2H2O(l)△H=-114.6kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列用来表示物质变化的化学用语中,正确的是( )
A. CO32-的水解方程式:CO32-+H2O![]() HCO3-+OH-
HCO3-+OH-
B. HS-的水解方程式:HS-+H2O![]() S2-+H3O+
S2-+H3O+
C. 钢铁发生电化学腐蚀的正极反应式:Fe-2e-=Fe2+
D. AlCl3溶液与Na2CO3溶液混合:2Al3++3CO32-=Al2(CO3)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图曲线表示物质A生成物质P的化学反应在无催化条件和有酶催化条件下的能量变化过程。据图判断不正确的是
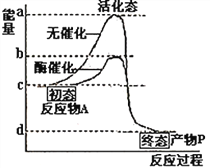
A. bc段表示在有酶催化条件下,使物质A生成物质P反应发生需要的活化能
B. ad段表示在无催化剂催化的条件下,使物质A生成物质P反应发生需要的活化能
C. 若物质A与物质P之间转化的反应为可逆反应,酶可同样地降低正、逆反应的活化能
D. 若将酶催化改为无机催化剂催化该反应,则b在纵轴上将向上移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置或操作与说法正确的是( )

A. 实验室制乙烯
B. 实验室制乙炔并验证乙炔能发生氧化反应
C. 实验室中分馏石油
D. 若甲为醋酸,乙为贝壳(粉状),丙为苯酚钠溶液,则该装置不可以验证醋酸、碳酸、苯酚酸性的强弱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com