
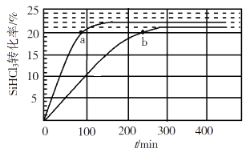
【题目】向1L恒容密闭容器中充入2mol SiHCl3,采用大孔弱碱性阴离子交换树脂催化剂,在323 K和343 K时发生反应2SiHCl3(g)=SiH2Cl2(g)+SiCl4(g) ΔH,SiHCl3的转化率随时间变化的结果如图所示。
(1)上述反应每生成1g SiH2Cl2(g)吸收1.1kJ热量,则ΔH=______________。
(2)323K时,反应的平衡转化率α=______________。
(3)343K时,前200min内,SiCl4(g)的平均反应速率为______________。
(4)比较a、b两处反应速率大小![]() _______(填“>”“<”或“=”)
_______(填“>”“<”或“=”)![]() 。
。
(5)在343K条件下,要缩短反应达到平衡的时间,并且要增大平衡时SiH2Cl2(g)的浓度,可采取的措施是______________________。
【答案】+111.1kJ/mol 21% 0.0011mol/(L·min) > 增大压强
【解析】
(1)根据物质反应的能量变化与物质的变化成正比,计算产生1mol SiH2Cl2吸收的能量,就可得到反应热;
(2)根据该反应的正反应是吸热反应,利用温度对化学平衡移动的影响,结合图像分析判断。
(3)在343K时,先计算前200min内SiHCl3的反应速率,然后根据物质反应转化关系,计算SiCl4(g)的平均反应速率;
(4)根据温度对化学反应速率的影响分析比较;
(5)根据外界条件对化学反应速率和化学平衡移动分析。
(1)生成1g SiH2Cl2(g)反应吸收1.1kJ热量,则反应产生1mol SiH2Cl2吸收热量为Q=101×1.1kJ=111.1kJ,所以该反应的热化学方程式为:2SiHCl3(g)=SiH2Cl2(g)+SiCl4(g) ΔH =+111.1kJ/mol,反应热为+111.1kJ/mol ;
(2)由于该反应的正反应是吸热反应,升高温度,平衡向吸热的正反应方向移动,反应物的转化率增大,所以曲线b是323K时的反应曲线,由图像可知此时反应物的平衡转化率为21%;
(3)根据图像可知:在343K时,前200min内SiHCl3的转化率是22%,在反应开始时加入2mol SiHCl3,容器的容积是1L,则反应速率υ(SiHCl3)= =0.0022mol/(L·min),根据方程式可知υ(SiCl4):υ(SiHCl3)=1:2,所以υ(SiCl4)= 0.0011mol/(L·min);
=0.0022mol/(L·min),根据方程式可知υ(SiCl4):υ(SiHCl3)=1:2,所以υ(SiCl4)= 0.0011mol/(L·min);
(4)a、b两点物质的转化率相同,物质的浓度相等,由于温度a>b,温度越高,反应速率越快,所以a、b两处反应速率大小:![]() >
>![]() ;
;
(5)在343K条件下,要缩短反应达到平衡的时间,反应速率就要加快,同时要增大平衡时SiH2Cl2(g)的浓度,可采取的措施是只能是增大压强。


科目:高中化学 来源: 题型:
【题目】苯乙腈主要用于有机合成及生产医药,农药的中间体,对环境有危害。常温常压下,苯乙腈水解一般需加入酸碱催化剂。但研究人员发现,在近临界水(指温度在523~623K之间的压缩液态水)中,不加任何催化剂的情况下,苯乙腈就能发生水解反应生成苯乙酞胺:
C6H5CH2CN(l)+H2O(l)![]() C6H5CH2CONH2(l) △H
C6H5CH2CONH2(l) △H
(苯乙腈) (苯乙酰胺)
请回答下列问题:
(1)己知近临界水中,水的离子积常数为10-10,则此条件下,pH=7的NaAc溶液中由水电离的c(H+)=________ mol·L-1。该反应不加任何催化剂就能发生的主要原因是___________。
(2)研究反应的平衡常数(记作lgK)与温度(T)的关系,得到如图1所示的关系,判断该反应的△H__________0(填“>”“<”或“=”)。
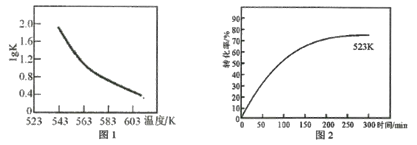
(3)图2表示其他条件不变时,温度和时间对苯乙腈转化率的影响曲线图(不完整)。若图中曲线对应的温度为523K,请你在原图中作出温度为583K的影响曲线。___________。
(4)下列哪种仪器可用于分析水解反应过程中苯乙腈浓度的变化_________(填编号)。
A.元素分析仪 B.核磁共振仪 C.原子吸收光谱仪 D.分光光度计
(5)科学家还在近临界水中分别添加CO2、NH3,研究后得到了如下的图示:
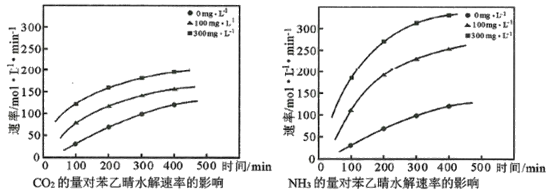
从中你可以得出什么结论(至少写出2点___________。
(6)水的用途很广,可利用太阳能光伏电池电解水制高纯氢,工作示意图如图。通过控制开关连接K1或K2,可交替得到H2和O2。
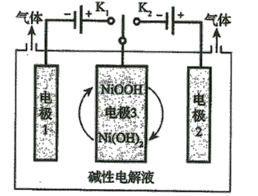
①制H2时,连接______________,可得H2。
②改变开关连接方式,产生O2的电极反应式__________________________。
③选用NiOOH、Ni(OH)2作为电极3材料的优点(请结合电极反应式进行阐述)___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应的离子方程式正确的是( )
A. 氯化铝溶液与过量的氨水反应:Al3++4NH3·H2O===AlO![]() +4NH
+4NH![]() +2H2O
+2H2O
B. 小苏打溶液中加入过量的澄清石灰水:Ca2++2OH-+2HCO![]() ===CaCO3↓+ CO
===CaCO3↓+ CO![]() +2H2O
+2H2O
C. 纯碱溶液中滴加少量盐酸:CO32-+H+===HCO![]()
D. 用FeCl3溶液腐蚀铜电路板:Fe3++ Cu === Fe2++ Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列物质:①氢氧化钡固体 ②KHSO4 ③HNO3 ④稀硫酸 ⑤二氧化碳气体 ⑥铁 ⑦碳酸钠粉末 ⑧蔗糖晶体 ⑨熔融氯化钠 ⑩CuSO4·5H2O晶体。请用序号填空:
(1)上述状态下可导电的是___。
(2)属于电解质的是___。
(3)属于非电解质的是____。
(4)⑥和水蒸气反应的化学方程式为___,①与②在溶液中反应使溶液呈中性的离子方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备1,2-二溴乙烷的反应原理如下:![]()
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚.用少量溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示:有关数据列表如下:
回答下列问题:
乙醇 | 1,2—二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g.cm-3- | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -130 | 9 | -116 |
【1】在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是______;(填正确选项前的字母)
a 引发反应 b 加快反应速度 c 防止乙醇挥发 d 减少副产物乙醚生成
【2】装置B的作用_____________。
【3】在装置C中应加入______,其目的是吸收反应中可能生成的酸性气体;(填正确选项前的字母)
a 水 b 浓硫酸 c 氢氧化钾溶液 d 饱和碳酸氢钠溶液
【4】判断该制备反应已经结束的最简单方法是___________;将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在______层(填“上”、“下”);
【5】若产物中有少量未反应的Br2,最好用________洗涤除去;若产物中有少量副产物乙醚,可用____的方法除去;
【6】反应过程中应用冷水冷却装置D,其主要目的是_______;
【7】但又不能过度冷却(如用冰水),其原因是_______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向NaOH和Na2CO3混合溶液中滴加0.1mol/L稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示.下列判断正确的是(
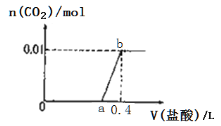
A. 在0~a范围内,只发生中和反应
B. 原混合溶液中NaOH与Na2CO3的物质的量之比为1:2
C. a = 0.3
D. ab段发生反应的离子方程式为:CO32-+2H+=H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用海水可以提取溴和镁,提取过程如下:

(1)提取溴的过程中,经过2次Br-→Br2转化的目的是_______,吸收塔中发生反应的离子方程式是SO2+Br2+2H2O=4H++2Br-+SO42-,蒸馏塔中发生反应的离子方程式是_____。
(2)从MgCl2溶液中得到MgCl26H2O晶体的主要操作是_________、冷却结晶、过滤、洗涤、干燥。由无水氯化镁得到镁的化学方程式是___。
(3)海水提取镁要用到海滩上的贝壳,贝壳的作用是:_______,贝壳经历变化的化学方程式为:____,CaO+H2O = Ca(OH)2
(4)六水合氯化镁脱水变成无水氯化镁的工艺条件是:____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某容器中发生一个化学反应,反应过程中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种离子。在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示。下列有关判断中不正确的是( )
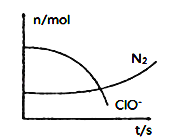
A.标准状况下若生成2.24LN2,则转移电子1mol
B.还原性:Cl-<CN-
C.参与反应的氧化剂与还原剂的物质的量之比为5:2
D.氧化剂是含ClO-的物质,氧化产物只有N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用铁的氧化物在高温条件下循环裂解水制氢气的流程如下图所示。

(1)反应I的化学方程式为:Fe3O4(s)+CO(g)![]() 3FeO(s)+CO2(g),反应Ⅱ的化学方程式为_________,对比反应I、Ⅱ,铁的氧化物在循环裂解水制氢气过程中的作用是_________。用化学方程式表示反应I、Ⅱ、Ⅲ的总结果:_________。
3FeO(s)+CO2(g),反应Ⅱ的化学方程式为_________,对比反应I、Ⅱ,铁的氧化物在循环裂解水制氢气过程中的作用是_________。用化学方程式表示反应I、Ⅱ、Ⅲ的总结果:_________。
(2)反应III为:CO2(g)+C(s)![]() 2CO(g)
2CO(g) ![]() H>0。为了提高达平衡后CO的产量,理论上可以采取的合理措施有_________(任写一条措施)。
H>0。为了提高达平衡后CO的产量,理论上可以采取的合理措施有_________(任写一条措施)。
(3)上述流程中铁的氧化物可用来制备含有Fe3+的刻蚀液,用刻蚀液刻蚀铜板时,可观察到溶液颜色逐渐变蓝,该反应的离子方程式为_________。刻蚀液使用一段时间后会失效,先加酸,再加入过氧化氢溶液,可实现刻蚀液中Fe3+的再生,该反应的离子方程式为_________。
(4)上述流程中碳的氧化物可用来制备碳酰肼[CO(NHNH2)2,其中碳元素为+4价]。加热条件下,碳酰肼能将锅炉内表面锈蚀后的氧化铁转化为结构紧密的四氧化三铁保护层,并生成氮气、水和二氧化碳。该反应的化学方程式为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com