
【题目】下列说法不正确的是( )
A.减压蒸馏可以防止炭化结焦
B.石油裂化的目的是提高汽油的产量和质量
C.石油的常压蒸馏,减压蒸馏以及煤的干馏都是物理变化
D.芳香烃的主要来源是石油的催化重整和煤的干馏
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
【题目】1000mL某待测液中除含有0.2molL﹣1的Na+外,还可能含有下列离子中的一种或多种:
阳离子 | K+、NH4+、Fe3+、Ba2+ |
阴离子 | Cl﹣、Br﹣、CO32﹣、HCO3﹣、SO32﹣、SO42﹣ |
现进行如下实验操作(所加试剂均过量):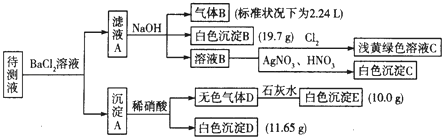
(1)写出生成白色沉淀B的离子方程式: .
(2)若无色气体D是单一气体: ①将阴离子的物质的量浓度填入下表中(一定不存在的填“0”,不能确定的填“?”):
阴离子 | Cl﹣ | Br﹣ | CO32﹣ | HCO3﹣ | SO32﹣ | SO42﹣ |
浓度/molL﹣1 |
②判断原溶液中K+是否存在,若存在,求其物质的量浓度的最小值,若不存在,请说明理由: .
(3)若无色气体D是混合气体,待测液中一定含有的阴离子是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学学习小组利用右图装置来制取乙酸乙酯。
I.实验过程:向试管a中加入碎瓷片,3mL乙醇,然后边振荡试管边慢慢加入2mL浓硫酸,最后加入2mL乙酸,按右图连接好装置,用酒精灯缓慢加热,将产生的蒸汽经导管通到b试管中的液面上。

II. 已知化学方程式:
![]()
III.查阅资料得知:乙酸乙酯不溶于水,密度比水小,且有香味
请回答下列问题:
(1)此反应中浓硫酸起________、________作用;
(2)试管a中加入碎瓷片,其作用是_____(填字母代号)
A.加快化学反应速率 B.防止溶液暴沸
(3)试管b中的溶液是_____(填字母代号)
A.饱和碳酸钠溶液 B.饱和氢氧化钠溶液
b中发生的化学方程式是_____________________________________。
(4)实验完毕后,将b试管中的液体充分振荡,静置后,溶液分为两层
①乙酸乙酯在________(填“上层”或“下层”)
②常用________操作将两层液体分离(填“过滤”或“分液”)
(5)实验中加入乙酸的质量为2.1g,其中60%的乙酸发生酯化反应,则得到乙酸乙酯的质量为______g(计算结果保留两位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阴离子Xn﹣1含中子N个,X的质量数为A,则ag X的氢化物中含质子的物质的量是( )
A.![]() (N﹣a) mol
(N﹣a) mol
B.![]() (n+A)mol
(n+A)mol
C.![]() (N+n) mol
(N+n) mol
D.![]() (A﹣N+n) mol
(A﹣N+n) mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将SO2气体分别通入下列四种溶液中,有关现象及结论的说法正确的是( ) 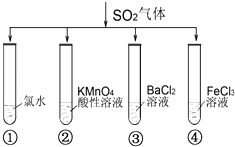
A.试管①中有淡黄色沉淀生成,说明SO2有氧化性
B.试管②中溶液褪色,说明SO2有漂白性
C.试管③中能产生白色沉淀,说明SO2有酸性
D.试管④中溶液颜色变浅,说明SO2有还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图装置,能完成很多电化学实验。下列有关此装置的叙述中,不正确的是

A. 若X为锌棒,Y为NaCl溶液,开关K置于M处,可减缓铁的腐蚀,这种方法称为牺牲阳极的阴极保护法
B. 若X为碳棒,Y为NaCl溶液,开关K置于N处,可减缓铁的腐蚀,溶液中的阳离子向铁电极移动
C. 若X为铜棒,Y为硫酸铜溶液,开关K置于M处,铜棒质量将增加,此时外电路中的电子向铜电极移动
D. 若X为铜棒,Y为硫酸铜溶液,开关K置于N处,铁棒质量将增加,溶液中铜离子浓度将减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图装罝制取ClO2,并以ClO2为原料制备亚氯酸钠(NaClO2是—种高效氧化剂、漂白剂)。己知:NaClO2饱和溶液在温度低于38℃时析出的晶体是NaC1O2·3H2O,高于38℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
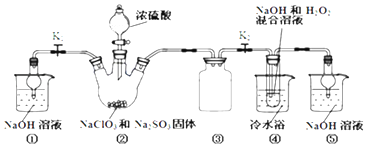
完成下列填空:
(1)装置②中产生ClO2的化学方程式为________。装置④中发生反应的离子方程式为_______。
(2)装置③的作用是_____________________。
(3)装置④反应后的溶液获得NaClO2晶体的操作步骤为:①减压,55℃蒸发结晶;②___;③___;④低于60℃干燥,得到成品。
(4)装置④反应后的溶液中还含有少量NaOH杂质,从该溶液获得无水NaClO2晶体的操作步骤为:①减压,55℃左右蒸发结晶;②趁热过滤:③用50℃左右的温水洗涤;④低于60℃干燥,得到成品。步骤③中用50℃左右的温水洗涤的原因______________________。
(5)①亚氯酸钠纯度测定:准确称取所得亚氯酸钠样品10.0g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应。将所得混合液配成250mL待测溶液。②取25.00mL待测液,恰好与20mL 2.0mol·L-1 Na2S2O3完全反应(I2 +2S2O32-=2I-+S4O62-),则该样品中NaClO2的质量分数为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所给信息填空
(1)用0.1mol/L的酸性高锰酸钾溶液测定FeSO4溶液的浓度时,因FeSO4溶液放置时间较长,导致测定结果(填“偏大”、“不变”或“偏小”)
(2)过氧化钠的电子式
(3)选出下列说法中正确的
①氧化物都能与酸或碱的溶液反应
②红宝石、玛瑙、水晶、钻石等装饰品的主要成分都是硅酸盐
③由相同元素组成的物质一定是纯净物
④浓氨水滴加到FeCl3溶液中可制取Fe(OH)3胶体
⑤向容量瓶中转移液体时,玻璃棒不可以接触到容量瓶的瓶口
⑥用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液
⑦金属Mg的活泼性比Al强,由Al2O3能与NaOH溶液反应推知MgO也能与NaOH溶液反应
⑧SiO2既能和NaOH溶液反应也能和氢氟酸反应,所以是两性氧化物
⑨3mol单质Fe在氧气中完全转变为Fe3O4 , 失去8NA个电子
⑩用含硅胶、铁粉的透气小袋与食品一起密封包装,利用了Fe粉的还原性
(4)浓硝酸久置变黄
(5)明矾溶液与少量氢氧化钡溶液反应的离子方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】13CNMR(核磁共振)、15NNMR可用于测定蛋白质、核酸等生物大分子的空间结构,这项研究曾获诺贝尔化学奖。下面有关叙述正确的是
A. 15N的核外电子数比中子数少1 B. 14N与14C互为同位素
C. 15N与14N为同一种核素 D. 13C与15N有相同的中子数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com