
【题目】利用下图装罝制取ClO2,并以ClO2为原料制备亚氯酸钠(NaClO2是—种高效氧化剂、漂白剂)。己知:NaClO2饱和溶液在温度低于38℃时析出的晶体是NaC1O2·3H2O,高于38℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
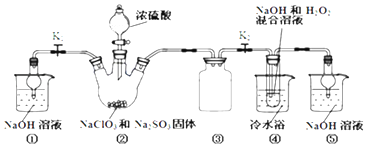
完成下列填空:
(1)装置②中产生ClO2的化学方程式为________。装置④中发生反应的离子方程式为_______。
(2)装置③的作用是_____________________。
(3)装置④反应后的溶液获得NaClO2晶体的操作步骤为:①减压,55℃蒸发结晶;②___;③___;④低于60℃干燥,得到成品。
(4)装置④反应后的溶液中还含有少量NaOH杂质,从该溶液获得无水NaClO2晶体的操作步骤为:①减压,55℃左右蒸发结晶;②趁热过滤:③用50℃左右的温水洗涤;④低于60℃干燥,得到成品。步骤③中用50℃左右的温水洗涤的原因______________________。
(5)①亚氯酸钠纯度测定:准确称取所得亚氯酸钠样品10.0g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应。将所得混合液配成250mL待测溶液。②取25.00mL待测液,恰好与20mL 2.0mol·L-1 Na2S2O3完全反应(I2 +2S2O32-=2I-+S4O62-),则该样品中NaClO2的质量分数为___。
【答案】 2NaClO3+Na2SO3+H2SO4=2ClO2+2Na2SO4+H2O 2ClO2+H2O2+2OH =2ClO2 +2H2O+O2↑ 防止倒吸 过滤 洗涤 防止生成NaClO2·3H2O晶体和温度过高产品分解 90.5%
【解析】本题主要考查对于制备亚氯酸钠实验的评价。
(1)装置②中产生ClO2,NaClO3→ClO2,Na2SO3→Na2SO4,反应的化学方程式为2NaClO3+Na2SO3+H2SO4=2ClO2+2Na2SO4+H2O。装置④中,ClO2→NaClO2,H2O2→O2,发生反应的离子方程式为2ClO2+H2O2+2OH=2ClO2+2H2O+O2↑。
(2)装置③的作用是防止倒吸。
(3)装置④反应后的溶液获得NaClO2晶体的操作步骤为:①减压,55℃蒸发结晶;②过滤;③洗涤;④低于60℃干燥,得到成品。
(4)步骤③中用50℃左右的温水洗涤的原因:防止温度过低生成NaClO2·3H2O晶体和温度过高产品分解。
(5)NaClO2~2I2~4S2O32-,该样品中NaClO2的质量分数为(0.02L×2.0mol·L-1)/4×90.5g/mol/1.00g=90.5%。


 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】六氟化硫分子呈正八面体形(如图所示),在高电压下仍有良好的绝缘性,在电器工业方面有着广泛的用途,但逸散到空气中会引起温室效应,下列有关六氟化硫的推测正确的是( ) 
A.六氟化硫易燃烧生成二氧化硫
B.六氟化硫中各原子均达到8电子稳定结构
C.六氟化硫分子中的S﹣F键都是σ键,且键长、键能都相等
D.六氟化硫分子是极性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列原子或离子的电子排布的表示方法中,正确的是 , 违反了能量最低原理的是 , 违反洪特规则的是 .
①Ca2+:1s22s22p63s23p6
②F﹣:1s22s23p6
③ ![]()
④Cr:1s22s22p63s23p63d44s2
⑤Fe:1s22s22p63s23p63d64s2
⑥Mg2+:1s22s22p6
⑦ ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.减压蒸馏可以防止炭化结焦
B.石油裂化的目的是提高汽油的产量和质量
C.石油的常压蒸馏,减压蒸馏以及煤的干馏都是物理变化
D.芳香烃的主要来源是石油的催化重整和煤的干馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有OH﹣ , CO32﹣ , AlO2﹣ , SiO32﹣ , SO42﹣ , Na+ , Fe3+ , Mg2+ , Al3+等离子,当向溶液中逐滴加入一定物质的量的盐酸时,生成沉淀物质的量与加入盐酸体积的关系如图所示.下列判断正确的是( ) 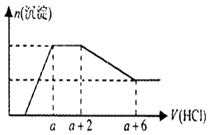
A.原溶液中一定含有Na2SO4
B.反应后形成的溶液溶质为NaCl
C.原溶液中含有CO32﹣与AlO2﹣的物质的量比为1:1
D.原溶液中一定含有的离子是OH﹣ , CO32﹣ , SiO32﹣ , AlO2﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是种无色气体,具有轻微的醚香味,其燃烧热为1455kJ·mol-1,甲醚可作燃料电池的燃料。
(1)写出甲醚燃烧的热化学方程式_______________________。
(2)工业上利用H2和CO2合成二甲醚的反应如下:6H2(g)+2CO2(g)![]() CH3OCH3(g)+H2O(g) △H<0 —定温度下,在一个固定体积的密闭容器中进行该反应,下列能判断反应达到化学平衡状态的是____(选填编号,注意大小写)。
CH3OCH3(g)+H2O(g) △H<0 —定温度下,在一个固定体积的密闭容器中进行该反应,下列能判断反应达到化学平衡状态的是____(选填编号,注意大小写)。
a.c(H2)与c(H2O)的比值保持不变
b.单位时间内有2mol H2消耗时,有lmolH2O生成
c.容器中气体密度不再改变
d.容器中气体压强不再改变
(3)以甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。请写出该电池中负极上的电极反应式是:________________________。
(4)用(3)中的燃料电池为电源,以石墨为电极电解500mLNaCl溶液,装置如图所示,请写出电解过程中Y电极附近观察到的现象是____________;当燃料电池消耗2.8LO2 (标准状况下)时,计算此时:NaCl溶液中C(OH-)=______________mol/L (假设溶液的体积不变,气体全部从溶液中逸出)。
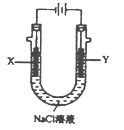
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含Fe2+、I﹣、Br﹣的溶液中通入过量的氯气,溶液中四种粒子的物质的量变化如图所示,已知b﹣a=5,线段Ⅳ表示一种含氧酸,且Ⅰ和Ⅳ表示的物质中含有相同的元素.下列说法正确的是( )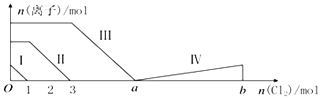
A.线段Ⅱ表示Br﹣的变化情况
B.线段Ⅳ表示IO3﹣的变化情况,其中IO3﹣增加了5moL.
C.a=6
D.原溶液中n(FeI2):n(FeBr2)=3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质与用途具有对应关系的是
A. 二氧化锰具有较强的氧化性,可作H2O2分解的氧化剂
B. 铝能置换出氧化铁中的铁,可用于钢铁工业中大量冶炼铁
C. AlCl3是电解质,可电解熔融AlCl3制铝
D. 油脂能在碱性条件下水解,可用于工业上制取肥皂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列鉴别物质的方法能达到目的的是
A. 用氨水鉴别MgCl2溶液和AlCl3溶液
B. 用澄清石灰水鉴别Na2CO3溶液和NaHCO3溶液
C. 用KSCN溶液鉴别FeCl3溶液和FeCl2溶液
D. 用淀粉溶液鉴别加碘盐和未加碘盐(己知加碘盐中添加的是KIO3)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com