
【题目】六氟化硫分子呈正八面体形(如图所示),在高电压下仍有良好的绝缘性,在电器工业方面有着广泛的用途,但逸散到空气中会引起温室效应,下列有关六氟化硫的推测正确的是( ) 
A.六氟化硫易燃烧生成二氧化硫
B.六氟化硫中各原子均达到8电子稳定结构
C.六氟化硫分子中的S﹣F键都是σ键,且键长、键能都相等
D.六氟化硫分子是极性分子
科目:高中化学 来源: 题型:
【题目】图为实验室从海带中提取碘单质的流程示意图,判断下列说法错误的是( ) 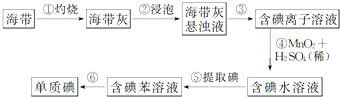
A.步骤①需要用到蒸发皿
B.步骤③需要过滤装置
C.步骤⑤需要用到分液漏斗
D.步骤⑥需要蒸馏装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2008年北京奥运会的“祥云”火炬所用燃料的主要成分是丙烷,下列有关丙烷的叙述不正确的是( )
A.比丁烷更易液化B.光照能够发生取代反应
C.分子中的碳原子不在一条直线上D.是石油分馏的一种产品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1000mL某待测液中除含有0.2molL﹣1的Na+外,还可能含有下列离子中的一种或多种:
阳离子 | K+、NH4+、Fe3+、Ba2+ |
阴离子 | Cl﹣、Br﹣、CO32﹣、HCO3﹣、SO32﹣、SO42﹣ |
现进行如下实验操作(所加试剂均过量):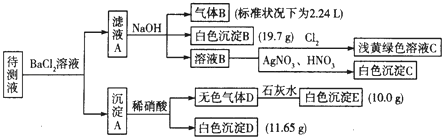
(1)写出生成白色沉淀B的离子方程式: .
(2)若无色气体D是单一气体: ①将阴离子的物质的量浓度填入下表中(一定不存在的填“0”,不能确定的填“?”):
阴离子 | Cl﹣ | Br﹣ | CO32﹣ | HCO3﹣ | SO32﹣ | SO42﹣ |
浓度/molL﹣1 |
②判断原溶液中K+是否存在,若存在,求其物质的量浓度的最小值,若不存在,请说明理由: .
(3)若无色气体D是混合气体,待测液中一定含有的阴离子是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中二氧化硫、氮氧化物和可吸入颗粒物是雾霾主要组成.某课题组用汽车尾气为原料探究二氧化硫、氮氧化物的化学性质.
(1)I.汽车尾气(含有烃类、CO、SO2与NO等物质),冶理的方法之一是在汽车的排气管上装一个“催化转换器”(用铂、钯合金作催化剂).它的特点是使CO与NO反应,生成可参与大气生态环境循环的无毒气体,并促使烃类充分燃烧及SO2的转化.写出一氧化碳与一氧化氮反应的化学方程式: Ⅱ.课题组欲在绿色环保的条件下探究大气污染物SO2的性质,设计如图实验装置.请回答:
B、C、D分别用于检验SO2的漂白性、还原性和氧化性,则B中所盛试剂为;C中反应的离子方程式为 .
(2)为了实现绿色环保的目标,制取SO2装置最好选择 . (A1或A2装置)用氨水吸收尾气中的SO2 , “吸收液”中可能含有OH﹣、SO32﹣、SO42﹣、HSO3﹣等阴离子.请回答:
(3)氨水吸收过量SO2的反应的离子方程式为
(4)已知亚硫酸氢盐一般易溶于水,SO2也易溶于水.现有仪器和试剂为:小烧杯、试管、玻璃棒、胶头滴管、过滤装置和滤纸;2mol/L盐酸、2mol/LHNO3、1mol/LBaCl2溶液、l mol/LBa(OH)2溶液、品红溶液、蒸馏水.请设计实验证明“吸收液”中存在SO32﹣、HSO3﹣ , 完成下表的实验操作、预期现象和结论:
实验操作 | 预期现象与结论 |
步骤1:取适量“吸收液”于小烧杯中,用胶头滴管取l mol/L BaCl2溶液向小烧杯滴加直至过量. | 若出现白色浑浊,则溶液中存在SO32﹣或 SO42﹣ . |
步骤2:将小烧杯中的浊液过滤、洗涤,再用适量水把附在滤纸上的固体冲入另一小烧杯中;向冲下的固体 . |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气主要的危害是形成光化学烟雾,危害人类健康.HNCO可用于消除汽车尾气中的NO和NO2 , 其反应原理为:HNCO+NOx→N2+CO2+H2O,下列说法正确的是( )
A.CO2分子中既含有极性键又含有非极性键
B.4.3g HNCO中含有0.1NA个原子
C.反应中NOx是还原剂
D.若NOx中x=2,1mol NO2在反应中转移4NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应在生产、生活中应用广泛。下列反应不属于氧化还原反应的是
A. 木炭燃烧:C + O2![]() CO2
CO2
B. 煅烧石灰石:CaCO3 ![]() CaO + CO2 ↑
CaO + CO2 ↑
C. 铁的冶炼:Fe2O3+3CO![]() 2Fe+3CO2
2Fe+3CO2
D. 电解水: 2H2O ![]() 2 H2 ↑ + O2 ↑
2 H2 ↑ + O2 ↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学学习小组利用右图装置来制取乙酸乙酯。
I.实验过程:向试管a中加入碎瓷片,3mL乙醇,然后边振荡试管边慢慢加入2mL浓硫酸,最后加入2mL乙酸,按右图连接好装置,用酒精灯缓慢加热,将产生的蒸汽经导管通到b试管中的液面上。

II. 已知化学方程式:
![]()
III.查阅资料得知:乙酸乙酯不溶于水,密度比水小,且有香味
请回答下列问题:
(1)此反应中浓硫酸起________、________作用;
(2)试管a中加入碎瓷片,其作用是_____(填字母代号)
A.加快化学反应速率 B.防止溶液暴沸
(3)试管b中的溶液是_____(填字母代号)
A.饱和碳酸钠溶液 B.饱和氢氧化钠溶液
b中发生的化学方程式是_____________________________________。
(4)实验完毕后,将b试管中的液体充分振荡,静置后,溶液分为两层
①乙酸乙酯在________(填“上层”或“下层”)
②常用________操作将两层液体分离(填“过滤”或“分液”)
(5)实验中加入乙酸的质量为2.1g,其中60%的乙酸发生酯化反应,则得到乙酸乙酯的质量为______g(计算结果保留两位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图装罝制取ClO2,并以ClO2为原料制备亚氯酸钠(NaClO2是—种高效氧化剂、漂白剂)。己知:NaClO2饱和溶液在温度低于38℃时析出的晶体是NaC1O2·3H2O,高于38℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
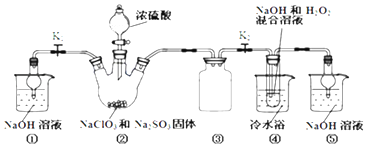
完成下列填空:
(1)装置②中产生ClO2的化学方程式为________。装置④中发生反应的离子方程式为_______。
(2)装置③的作用是_____________________。
(3)装置④反应后的溶液获得NaClO2晶体的操作步骤为:①减压,55℃蒸发结晶;②___;③___;④低于60℃干燥,得到成品。
(4)装置④反应后的溶液中还含有少量NaOH杂质,从该溶液获得无水NaClO2晶体的操作步骤为:①减压,55℃左右蒸发结晶;②趁热过滤:③用50℃左右的温水洗涤;④低于60℃干燥,得到成品。步骤③中用50℃左右的温水洗涤的原因______________________。
(5)①亚氯酸钠纯度测定:准确称取所得亚氯酸钠样品10.0g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应。将所得混合液配成250mL待测溶液。②取25.00mL待测液,恰好与20mL 2.0mol·L-1 Na2S2O3完全反应(I2 +2S2O32-=2I-+S4O62-),则该样品中NaClO2的质量分数为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com