
【题目】下列检验试样中某离子的操作及结论不合理的是( )
A.先加HCl无明显现象,再加BaCl2有白色沉淀,一定有SO ![]()
B.加入稀盐酸产生能使澄清石灰水变浑浊的无味气体,则溶液中一定有CO ![]()
C.加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH ![]()
D.做焰色反应,末观察到焰色为紫色,则待测液中一定不含有钾元素
 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:
【题目】利用废铝箔(主要成分为Al、少量的Fe、Si等)既可制取有机合成催化剂AlBr3又可制取净水剂硫酸铝晶体[Al2(SO4)318H2O].
I.实验室制取无色的无水AlBr3(熔点:97.5℃,沸点:263.3~265℃)可用如图所示装置,主要实验步骤如下:
步骤1:将铝箔剪碎,用CCl4浸泡片刻,干燥,然后投入到烧瓶6中.
步骤2:从导管口7导入干燥的氮气,同时打开导管口l和4放空,一段
时间后关闭导管口7和1;导管口4接装有P2O5的干燥管.
步骤3:从滴液漏斗滴入一定量的液溴于烧瓶6中,并保证烧瓶6
中铝过剩.
步骤4:加热烧瓶6,回流一定时间.
步骤5:将氮气的流动方向改为从导管口4到导管口1.将装有
P2O5的干燥管与导管口1连接,将烧瓶6加热至270℃左右,使溴化铝
蒸馏进入收集器2.
步骤6:蒸馏完毕时,在继续通入氮气的情况下,将收集器2从3处
拆下,并立即封闭3处.
(1)步骤1中,铝箔用CCl4浸泡的目的是 .
(2)步骤2操作中,通氮气的目的是 .
(3)步骤3中,该实验要保证烧瓶中铝箔过剩,其目的是 .
(4)步骤4依据何种现象判断可以停止回流操作 .
(5)步骤5需打开导管口1和4,并从4通入N2的目的是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组欲通过实验方法验证Fe2+的某些性质.
(1)在实验前,依据Fe2+的性,填写了如表.
实验操作 | 预期现象 | 反应的离子方程式 |
向盛有新割FeSO4溶液的试管中滴入数滴浓硝酸,振荡 | 试管中产生红棕色气体,溶液颜色逐渐变黄 | Fe2++NO3﹣+2H+=Fe3++NO2↑+H2O |
依照表中操作,该小组进行实验.观察到液面上方气体逐渐变为红棕色,但试管中溶液颜色却变为深棕色.
(2)分别取少量反应后的溶液于两只试管中,一只滴加几滴KSCN溶液,溶液变为变红,则溶液中含有;另一只试管滴加几滴溶液,产生蓝色沉淀,则含有Fe2+ .
(3)该小组讨论认为深棕色可能是NO2或NO与铁的某一种离子发生反应引起的.
提出猜想:
ⅰ.NO2与Fe2+发生反应ⅱ.NO2 与Fe3+发生反应
ⅲ.NO与Fe2+发生反应ⅳ.
(4)该小组用如图装置进行探究: 
步骤 | 操作及现象 | 解释或结论 |
① | 关闭k、b,打开a,开始甲中反应,一段时间后,观察到丙中溶液逐渐变为深棕色,而丁中溶液无明显变化 | 溶液深棕色由与NO或NO2反应而的得到 |
② | 停止甲中反应,打开k、b,关闭a,持续通入N2一段时间 | 该操作的目的 |
③ | 更换新的丙、丁装置,再通一段时间N2后关闭k,使甲中反应继续,观察到的现象与步骤①中相同 | 乙瓶中发生的化学反应方程式为 |
(5)结合实验猜想,得出结论:
溶液呈深棕色的原因:肯定成立的是猜想;不确定的是猜想 , 有待后续实验进一步探究.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质按酸、碱、盐依次排列的是
A. 硫酸、碳酸钠、硫酸钠 B. 硫酸、烧碱、胆矾
C. 硫酸氢钠、生石灰、醋酸钠 D. 磷酸、熟石灰、苛性钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼元素在自然界主要以硼酸.硼酸盐和硼硅酸盐存在.请回答下列问题: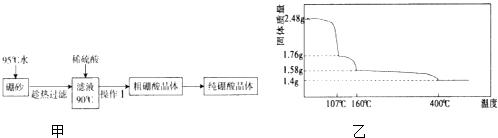
(1)硼元素是ⅢA族的第一个元素,原子结构示意图为 , 天然硼元素有两种稳定同位素10B、11B,其相对原子质量分别为10和11,它们的相对丰度分别为20%和80%,硼元素的平均相对质量为 .
(2)硼酸(H3BO3)是一元弱酸,工业上用硼砂(Na2B4O710H2O)制备硼酸晶体的流程如图甲:
不同温度下硼酸的溶解度见下表:
温度/℃ | 0 | 20 | 40 | 60 | 80 |
溶解度/g | 2.7 | 5.0 | 8.7 | 14.8 | 23.8 |
①写出硼砂溶液和稀硫酸反应的离子方程式 .
②上述流程中获得粗硼酸晶体的操作Ⅰ为、过滤,进一步将粗硼酸晶体提纯的方法是 .
③25℃时0.1mol/L硼酸溶液的pH约为5.1,则其电离常数K约为 .
(3)硼酸在加热过程中发生分解的失重曲线如图乙所示.
①硼酸从开始加热到107℃时,发生反应的化学方程式为 .
②硼酸加热到160℃得到的固体的化学式为 . (B元素的相对原子质量按11计算)
(4)NaBH4由于H元素显﹣1价,具有强还原性,是有机化学上的万能还原剂.在碱性条件下电解NaBO2溶液可以制得NaBH4 , 其反应方程式为NaBO2+2H2O=2O2↑+NaBH4 , 则阴极反应式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将过量的BaCl2溶液加入到250ml碳酸钠和硫酸钠的混合溶液中,充分反应后,过滤、洗涤、干燥后得到6.27g沉淀.向沉淀中加入过量的盐酸产生气体,最后有2.33g沉淀不溶.
(1)求此硫酸钠溶液的物质的量浓度.
(2)向沉淀中加入过量的盐酸充分反应,求最终产生的气体在标准状况下的体积.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有甲、乙两个完全相同的装置,分别在它们的侧管中装入1.06g Na2CO3和0.84g NaHCO3 , 试管中各有10mL相同浓度的盐酸(如图),同时将两个侧管中的物质全部倒入各自的试管中,下列叙述正确的是( ) 
A.甲装置的气球膨胀速率大
B.若最终两气球体积相同,则一定有c(HCl)≥2 mol/L
C.若最终两气球体积不同,则一定有c(HCl)≤1 mol/L
D.最终两溶液中Na+、Cl﹣的物质的量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于图中各装置的叙述不正确的是( ) 
A.装置①是中和滴定法测定硫酸的物质的量浓度
B.装置②中手捂烧瓶(橡胶管已被弹簧夹夹紧),发现导管中有液柱上升并保持稳定,则说明装置不漏气
C.装置③中X若为四氯化碳,可用于吸收氨气,并防止倒吸
D.装置④可检验溴乙烷发生消去反应得到的气体中含有乙烯(假定每个装置中吸收完全)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各选项中的两个反应,可用同一个离子方程式表示的是( )
选项 | Ⅰ | Ⅱ |
A | Ba(OH)2溶液与过量NaHCO3溶液混合 | NaOH溶液与过量NaHCO3溶液混合 |
B | 少量SO2通入Ba(OH)2溶液中 | 过量SO2通入Ba(OH)2溶液中 |
C | BaCl2溶液与Na2SO3溶液混合 | Ba(OH)2溶液与H2SO3溶液混合 |
D | 少量NaHCO3溶液滴入澄清石灰水中 | 少量NaOH溶液滴入Ca(HCO3)2溶液中 |
A.A
B.B
C.C
D.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com