
【题目】最近美国学者成功实现用氮气和水生产氨,其装置如下图所示:
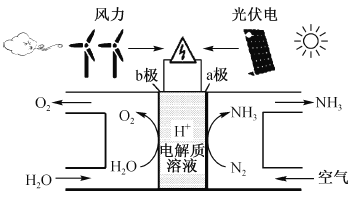
下列说法正确的是
A. 上图中的能量转化方式只有2种
B. a极发生的电极反应为N2 + 6H+ + 6e- = 2NH3
C. 装置工作时H+ 向b极区移动,电解质溶液pH减小
D. a极区与b极区产生的气体的物质的量之比为1 :1
科目:高中化学 来源: 题型:
【题目】一定温度下,10mL0.40molL-1H2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)( )
A.0~6min的平均反应速率:v(H2O2)≈3.3×10-2mol·L-1·min-1
B.6~10min的平均反应速率:v(H2O2)<3.3×10-2mol·L-1·min-1
C.反应至6min时,c(H2O2)=0.30mol·L-1
D.反应至6min时,H2O2分解了50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸是重要的化工材料,二氧化硫生成三氧化硫是工业制硫酸的重要反应之一。
(1)将0.050molSO2和0.030molO2放入容积为1L的密闭容器中,反应2SO2(g)+O2(g)![]() 2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040mol·L-1
2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040mol·L-1
①从平衡角度分析采用过量O2的目的是___。
②该条件下反应的平衡常数K=___。
③已知:K(300℃)>K(350℃),正反应是___(填“吸”或“放”)热反应。若反应温度升高,SO2的转化率___(填“增大”“减小”或“不变”)。
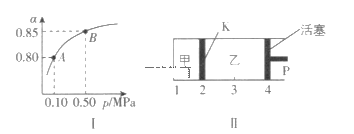
(2)某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如图I所示。平衡状态由A变到B时,平衡常数K(A)___K(B)(填“大于”“等于”或“小于”,下同)。
(3)如图II所示,保持温度不变,将2molSO2和1molO2加入甲容器中,将4molSO3加入乙容器中,隔板K不能移动。此时控制活塞P,使乙的容积为甲的2倍。
①若移动活塞P,使乙的容积和甲相等,达到新平衡时,SO3的体积分数甲___乙。
②若保持乙中压强不变,向甲、乙容器中通人等质量的氦气,达到新平衡时,SO3的体积分数甲___乙。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业从废铅酸蓄电池的渣泥(主要成分为PbSO4、PbO2)回收铅。RSR 工艺的主要流程如下:
![]()
(1)铅酸蓄电池放电时总反应为:
Pb(s) + PbO2(s) + 2H2SO4(aq) = 2PbSO4(s) + 2H2O(l)
正极反应:PbO2(s) + SO42-(aq) + 4H+(aq) + 2e- = PbSO4(s) + 2H2O(l)
负极反应:________。
(2)向渣泥中加入Na2CO3溶液将PbSO4转化为更难溶的PbCO3。
①用化学平衡移动原理解释其原因:________。
②工业上常用NaHCO3溶液代替Na2CO3溶液,将PbSO4转化为PbCO3。PbSO4与NaHCO3溶液或Na2CO3溶液不同物质的量比时,PbSO4的转化率见下表。
Ⅰ | n(PbSO4)∶ n(NaHCO3) | 1∶1.5 | 1∶2 | 1∶3 |
PbSO4转化率/% | 95.5 | 96.9 | 97.8 | |
Ⅱ | n(PbSO4)∶ n(Na2CO3) | 1∶1.5 | 1∶2 | 1∶3 |
PbSO4转化率/% | 98 | 98 | 98 |
依据上表数据,物质的量比相同时,Ⅱ中PbSO4的转化率比Ⅰ中的略大,原因是________。
③上述反应除生成PbCO3外,还可能生成碱式碳酸铅[2PbCO3·Pb(OH)2],二者受热都易分解生成PbO。通过实验确定产物中含有2PbCO3·Pb(OH)2,则该实验操作及现象是________;通过定量实验确定产物中2PbCO3·Pb(OH)2的含量,则需测定的数据是________。
(3)渣泥中加入Na2SO3溶液,利用其性质是________。
(4)H2SiF4溶液溶解PbCO3的化学方程式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在10mL0.1mol·L1 Na2CO3溶液中逐滴加入0.1mol·L1 HCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示,下列说法不正确的是
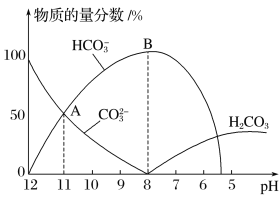
A.溶液的pH为7时,溶液的总体积大于20mL
B.在B点所示的溶液中:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)+c(Cl-)
C.在A点所示的溶液中:c(Na+)=c(CO32-)=c(HCO3-)>c(OH-)>c(H+)
D.已知CO32-水解常数为2×10-4,当溶液中c(HCO3-)=2c(CO32-)时,溶液的pH=10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将某一元酸![]() 甲、乙、丙、丁代表不同的一元酸
甲、乙、丙、丁代表不同的一元酸![]() 和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如表所示:
和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如表所示:
实验 编号 | HA的物质的 量浓度 | NaOH的物质的 量浓度 | 混合后溶液的pH |
甲 |
|
| pH |
乙 |
|
| pH |
丙 |
|
|
|
丁 |
|
| pH |
![]() 从甲组情况分析,从a值大小如何判断HA是强酸还是弱酸?________________________________________________________________________。
从甲组情况分析,从a值大小如何判断HA是强酸还是弱酸?________________________________________________________________________。
![]() 乙组混合溶液中
乙组混合溶液中![]() 和
和![]() 的大小关系是________
的大小关系是________![]() 填标号
填标号![]() 。
。
A.前者大 ![]() 后者大
后者大
C.二者相等 ![]() 无法判断
无法判断
![]() 从丙组实验结果分析,该混合溶液中
从丙组实验结果分析,该混合溶液中![]() __________
__________![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() 。
。
![]() 分析丁组实验数据,写出该混合溶液中下列算式的精确结果
分析丁组实验数据,写出该混合溶液中下列算式的精确结果![]() 列式
列式![]() :
:![]() __________
__________![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某二元酸H![]() B在水中的电离方程式是
B在水中的电离方程式是![]() 、HB
、HB![]() H
H![]() 。
。
![]() 的NaHB溶液显酸性,原因是________________________________。
的NaHB溶液显酸性,原因是________________________________。
![]() 在
在![]() 的Na2B溶液中,下列粒子浓度关系式正确的是________
的Na2B溶液中,下列粒子浓度关系式正确的是________![]() 填标号
填标号![]() 。
。
A.![]()
B.![]()
C.![]()
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,下列叙述不是可逆反应A(g)+3B(g)![]() 2C(g)达到平衡标志的是( )
2C(g)达到平衡标志的是( )
①C的生成速率与C的分解速率相等 ②单位时间内a mol A生成,同时生成 3amolB ③A、B、C的浓度不再变化 ④混合气体的总压强不再变化 ⑤混合气体的物质的量不再变化 ⑥单位时间消耗 a mol A,同时生成3a mol B ⑦A、B、C的分子数目比为1:3:2
A.②④⑤B.②⑦C.①③④D.⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知乙酸中的氧都是18O,则乙酸和乙醇在一定条件下反应,经过足够长的时间后,体系中含有18O的物质是
A. 只有乙酸
B. 只有乙酸乙酯
C. 乙酸、乙酸乙酯、水
D. 乙酸乙酯、乙醇、水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com