
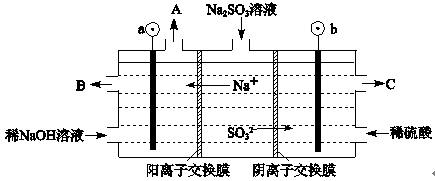
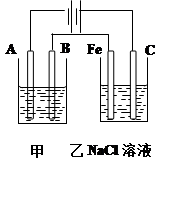
 H++OH—,在阴极H+放电生成H2,c(H+)减小,水的电离平衡正向移动,碱性增强
H++OH—,在阴极H+放电生成H2,c(H+)减小,水的电离平衡正向移动,碱性增强 H++OH—正向移动,所以碱性增强。
H++OH—正向移动,所以碱性增强。

 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源:不详 题型:单选题
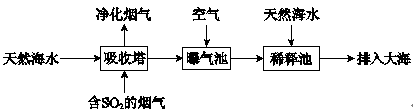
 ,恰好恢复到电解前的pH和浓度,则电解过程中转移的电子的物质的量为:
,恰好恢复到电解前的pH和浓度,则电解过程中转移的电子的物质的量为:| A.0.1mol | B.0.2mol | C.0.3mol | D.0.4mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
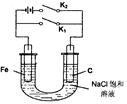
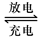 4LiCl +S+SO2,则下列叙述中不正确的是
4LiCl +S+SO2,则下列叙述中不正确的是| A.若仅闭合K2,铁极的电极反应式:Fe - 2e=Fe2+ |
| B.放电时电池上正极的电极反应式为:2SOCl2+4e =4C1-+S+SO2 |
| C.若仅闭合K1,电子由Fe极沿导线流向C极 |
| D.若不考虑气体溶解和溶液体积变化,当电池中生成0. 025molS时,溶液中pH=14 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
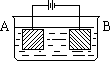
| A. 4︰1 | B.3︰1 | C. 2︰1 | D.任意比 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.1 mol | B.0.2 mol | C.0.3 mol | D.0.4 mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
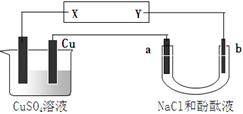
| A.NaCl溶液浓度不变 | B.X是负极,Y是正极 |
| C.CuSO4溶液浓度变小 | D.X是正极,Y是负极 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
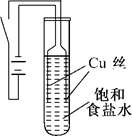
| 序号 | 操作 | 现象 |
| ① | 滴入稀硝酸溶液 | 沉淀溶解,有无色气泡产生,最终得到蓝色溶液 |
| ② | 滴入稀硫酸溶液 | 橙黄色沉淀转变为紫红色不溶物,溶液呈现蓝色 |
| 物质 | 颜色 | 物质 | 颜色 |
| 氯化铜 | 固体呈棕色,浓溶液呈绿色,稀溶液呈蓝色 | 氢氧化亚铜(不稳定) | 橙黄色 |
| 碱式氯化铜 | 绿色 | 氢氧化铜 | 蓝色 |
| 氧化亚铜 | 砖红色或橙黄色 | 氯化亚铜 | 白色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com