
常温,下列各组离子在指定溶液中能大量共存的是( )
A.pH=1的溶液中: I-、NO3-、SO42-、Na+
B.由水电离的c(H+)=1×10-14 mol·L-1的溶液中:Ca2+、K+、Cl-、HCO3-
C.c(H+)/c(OH-)=1012的溶液中: NH4+、Al3+、NO3-、Cl-
D.c(Fe3+)=0.1 mol·L-1的溶液中:K+、ClO-、SO42-、SCN-
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源:2015届江西省第一学期高三第一次月考化学(A卷)试卷(解析版) 题型:选择题
.把V L含有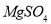 和
和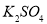 的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含?b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的浓度为( )
的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含?b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的浓度为( )
A. 
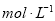 B.
B. 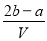
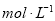
C. 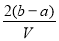
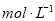 D.
D. 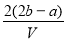
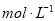
查看答案和解析>>
科目:高中化学 来源:2015届江西省高三上学期第一次月考化学试卷(解析版) 题型:填空题
铁单质及其化合物在生活、生产中应用广泛。请回答:
(1)钢铁在空气中发生吸氧腐蚀时,正极的电极反应是 。
(2)硫酸铁可作絮凝剂,常用于净水,其原理是 (用离子方程式表示)。在使用时发现硫酸铁不能将酸性废水中的悬浮物沉降除去,其原因是 。
(3)磁铁矿是工业上冶炼铁的原料之一,其原理是Fe3O4十4CO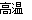 3Fe+4CO2,若有1.5 mol Fe3O4参加反应,转移电子的物质的量是 。
3Fe+4CO2,若有1.5 mol Fe3O4参加反应,转移电子的物质的量是 。
查看答案和解析>>
科目:高中化学 来源:2015届江西省高三上学期第一次月考化学试卷(解析版) 题型:选择题
向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是( )
| 操作 | 现象 | 结论 |
A | 滴加BaCl2溶液 | 生成白色沉淀 | 原溶液中有SO42- |
B | 滴加氯水和CCl4,振荡、静置 | 下层溶液显紫色 | 原溶液中有I- |
C | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 原溶液中有Na+,无K+ |
D | 滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH4+ |
查看答案和解析>>
科目:高中化学 来源:2015届江西省高三上学期第一次月考化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的数值,下列说法正确的是
A.常温下,23g NO2含有NA个氧原子
B.1 L 0.1 mol?L-1的氨水含有0.1NA个OH―
C.标准状况下,22.4 L CCl4含有NA 个CCl4分子
D.1 mol Fe2+与足量的H2O2溶液反应,转移2NA个电子
查看答案和解析>>
科目:高中化学 来源:2015届江西省南昌市高三8月月考化学试卷(解析版) 题型:填空题
(6分)在宏观—微观—符号之间建立联系,是化学学科特有的思维方式。汽车尾气是造成大气污染的主要原因之一,在汽车排气管上安装“催化转换器”便可以使汽车的尾气转换成无毒气体。如用●表示碳原子,用○表示氧原子,用 表示氮原子,下图为气体转换的微观过程。请你根据图示回答下列问题:
表示氮原子,下图为气体转换的微观过程。请你根据图示回答下列问题:
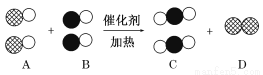
(1)A、B、C三种物质可以归为一类的依据是___________________________________。
(2)将C归为化合物,将D归为单质的理由是__________________________________。
(3)用化学反应方程式表示为________________________________。
化学变化过程中消耗的A物质和生成的C物质的质量比为________。
(4)从微观的角度去描述你获得的关于化学变化的有关信息(答出一条即可)____________ 。
查看答案和解析>>
科目:高中化学 来源:2015届江西省南昌市三校高三上第一次联考化学试卷(解析版) 题型:填空题
(6分)一定量的氢气在氯气中燃烧,所得混合物用100mL 6.00mol/L的NaOH溶液(密度为1. 2g/mL)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.1000mol。
(1)原NaOH溶液的质量分数为
(2)所得溶液中Cl-的物质的量为 mol
(3)所用氯气和参加反应的氢气的物质的量之比n(Cl2) :n(H2)= 。
查看答案和解析>>
科目:高中化学 来源:2015届江西省高三上学期第一次考试化学试卷(解析版) 题型:选择题
已知反应:①2K2CrO4+H2SO4=K2Cr2O7+K2SO4+H2O,
②K2Cr2O7+6FeSO4+7H2SO4=3Fe2(SO4)3+Cr2(SO4)3+K2SO4+7H2O,
③Fe2(SO4)3+2HI=2FeSO4+I2+H2SO4。下列结论正确的是
A.①②③均是氧化还原反应
B.氧化性强弱顺序是:K2Cr2O7>Fe2(SO4)3>I2
C.反应②中氧化剂与还原剂的物质的量之比为6∶1
D.反应③中0.1mol还原剂共失去电子数为1.2×1022
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com