
【题目】下列指定反应的离子方程式书写正确的是
A.硝酸铝溶液中滴加过量氨水:Al3++4NH3·H2O=AlO2-+4NH4+↑+2H2O
B.用铝粉和NaOH溶液反应制取大量H2:Al+2OH-=AlO2-+H2↑
C.实验室制取Cl2:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
D.氯气溶于水,与水的反应:Cl2+H2O=2H++Cl-+ClO-
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列浓度关系正确的是
A.0.1 mol/L的NH4HSO4溶液中滴加0.1 mol/L的Ba(OH)2溶液至沉淀刚好完全:c (NH4+)>c (OH-)>c (SO42-)>c (H+)
B.0.1 mol/L的KOH溶液中通入标准状况下的CO2气体3.36 L,所得溶液中:c (K+)+c (H+)=c (CO32-)+c (HCO3-)+c (OH-)
C.0.1 mol/L的NaOH溶液与0.2 mol/L的HCN溶液等体积混合,所得溶液呈碱性:c (HCN)>c (Na+)>c (CN-)>c (OH-)>c (H+)
D.pH相同的NaOH溶液、CH3COONa溶液、Na2CO3溶液、NaHCO3溶液的浓度:c (NaOH)<c (CH3COONa)<c (NaHCO3)<c (Na2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有短周期主族元素X、Y、Z、R、T。R原子最外层电子数是电子层数的2倍;Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的Z2T 化合物能破坏水的电离平衡,五种元素的原子半径与原子序数的关系如图所示,下列推断正确的是

A. 原子半径和离子半径均满足:Y<Z
B. Y的单质易与R、T的氢化物反应
C. 最高价氧化物对应的水化物的酸性:T<R
D. 由X、R、Y、Z四种元素组成的化合物水溶液一定显碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图甲为一种新型污水处理装置,该装置可利用一种微生物将有机废水的化学能直接转化为电能。图乙为电解氯化铜溶液的实验装置的一部分。下列说法中不正确的是
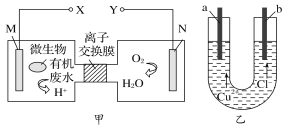
A. a极应与X连接
B. N电极发生还原反应,当N电极消耗11.2 L(标准状况下) O2时,则a电极增重64 g
C. 不论b为何种电极材料,b极的电极反应式一定为2Cl--2e-=Cl2↑
D. 若废水中含有乙醛,则M极的电极反应为:CH3CHO+3H2O-10e-=2CO2↑+10H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】nL三种气态烃混合物与足量氧气混合点燃后,恢复到原来状态(常温常压),体积共缩小2nL,这三种烃不可能的组合是 ( )
A. CH4、C2H4、C3H4以任意比混合
B. C2H6、C4H6、C2H2以2:1:2的物质的量之比混合
C. C3H8、C4H8、C2H2以11:14:26的质量之比混合
D. CH4、C3H6、C2H2以a:b:b体积比混合
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属锰及其化合物在工农业生产和科研领域具有广泛的应用。
Ⅰ.溶液中的Mn2+可被酸性(NH4)2S2O8溶液氧化为 MnO4-,该方法可用于检验Mn2+。
(1)用酸性(NH4)2S2O8溶液检验Mn2+时的实验现象为________。
(2)该反应的离子方程式为________。
(3)(NH4)2S2O8可视为由两分子硫酸缩合所得,则H2S2O8的结构式为 ________。
Ⅱ.实验室用含锰废料(主要成分为MnO2,还含有少量Al2O3、MgO、SiO2)为原料制备Mn的工艺流程如下图所示。

难溶物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 | Mn(OH)2 |
溶度积常数 | 4.0×10-38 | 1.0×10-33 | 1.8×10-11 | 1.8×10-13 |
(4)“酸浸”时,MnO2将Fe氧化为Fe3+,该反应的离子方程式为___________;该过程中浸出时间和液固比对锰浸出率的影响分别如下图所示。

则适宜的浸出时间和液固比分别为____________、____________。
(5)若“酸浸”后所得滤液中c(Mn2+)=0.18molL-1,则应“调pH”的范围为_________。
(6)“煅烧”反应中氧化剂与还原剂的物质的量之比为________。“还原”时发生的置换反应在化学上又叫作__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作能达到实验目的或得出相应结论的是
实 验 操 作 | 目的或结论 | |
A | 将Cu片放入FeCl3溶液中 | 证明Fe的金属性比Cu强 |
B | 将点燃的镁条置于盛有CO2的集气瓶中,瓶内壁有黑色固体生成 | 镁与CO2发生置换反应 |
C | 将SO2通入溴水或酸性高锰酸钾溶液中 | 证明SO2有漂白性 |
D | 向FeCl2溶液(含少量FeBr2杂质)中,加入适量氯水,再加CCl4萃取分液 | 除去FeCl2溶液中的FeBr2 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是
A.含有1mol原子的氢气在标准状况下的体积约为22.4 L
B.25 ℃,1.01×105Pa,64 g SO2中含有的原子数为3NA
C.1 mol/L的Na2SO4溶液含Na+数为2 NA
D.标准状况下,11.2 L H2O含有的分子数为9 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是原子序数依次增大的五种短周期主族元素,其中A的原子序数是B和D原子序数之和的1/4,C的原子半径在所有短周期主族元素中最大,甲和丙是D元素的两种常见氧化物,乙和丁是B元素的两种常见同素异形体,0.005 mol/L戊溶液的pH=2,它们之间的转化关系如图所示(部分反应物省略),下列叙述一定正确的是
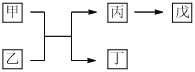
A. C、D两元素形成的化合物的原子个数比为1:2
B. C、E形成的化合物的水溶液呈碱性
C. 简单离子半径:D> C> B
D. 最高价氧化物对应水化物的酸性:E>A
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com