
【题目】某线型高分子化合物的结构简式如图所示:
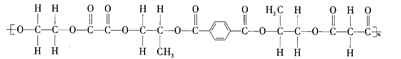
下列有关说法正确的是( )
A.该高分子化合物是由4种单体缩聚而成的
B.形成该高分子化合物的几种羧酸单体互为同系物
C.形成该高分子化合物的单体中的乙二醇可被![]() 催化氧化生成草酸
催化氧化生成草酸
D.该高分子化合物有固定的熔沸点,1mol该高分子化合物完全水解需要氢氧化钠的物质的量为5nmol
科目:高中化学 来源: 题型:
【题目】下列实验操作和结论错误的是( )
A.用新制![]() 悬浊液可鉴别麦芽糖和蔗糖
悬浊液可鉴别麦芽糖和蔗糖
B.用银镜反应可证明淀粉是否水解为葡萄糖,但不能证明其是否完全水解
C.浓硫酸可使蔗糖变黑,证明浓硫酸具有脱水性
D.向蔗糖溶液中滴加几滴稀硫酸后,水浴加热几分钟,将混合液再加入到银氨溶液中,不能发生银镜反应,则证明蔗糖没有发生水解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯碳酸锰在电子工业中有重要的应用,湿法浸出软锰矿(主要成分为MnO2,含少量Fe、Al、Mg等杂质元素)制备高纯碳酸锰的实验过程如下:其中除杂过程包括:①向浸出液中加入一定量的X,调节浸出液的pH为3.5~5.5;②再加入一定量的软锰矿和双氧水,过滤;③…下列说法正确的是( )
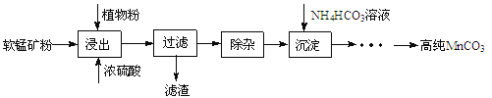
A.试剂X可以是MnO、MnO2、MnCO3等物质
B.浸出时加入植物粉的作用是作为还原剂
C.除杂过程中调节浸出液的pH为3.5~5.5可完全除去Fe、Al、Mg等杂质
D.为提高沉淀MnCO3步骤的速率可以持续升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20.00 mL 0.100 0 molL﹣1 (NH4)2SO4溶液中逐滴加入0.200 0 molL﹣1 NaOH溶液时,溶液的pH与所加NaOH溶液体积的关系如图所示(不考虑挥发)。下列说法正确的是
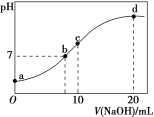
A. 点a所示溶液中:c(NH4+)>c(SO42-)>c(OH-)>c(H+)
B. 点b所示溶液中:c(NH4+)=c(Na+)>c(H+)=c(OH-)
C. 点c所示溶液中:c(SO42-)+c(H+)=c(NH3·H2O)+c(OH-)
D. 点d所示溶液中:c(SO42-)>c(NH3·H2O)>c(OH-)>c(NH4+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率变化可以确定滴定反应的终点。在一定温度下,用0.1mol/LKOH溶液分别滴定体积均为20mL、浓度均为0.1mol/L的盐酸和醋酸溶液,滴定曲线如图所示。下列有关判断正确的是
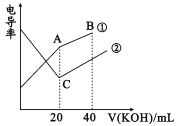
A. B点的溶液中有:c(K+)>c(OH-)>c(CH3COO-)>c(H+)
B. A点的溶液中有:c(CH3COO-)+c(OH-)-c(H+)=0.1mol/L
C. C点水电离的c(OH-)大于A点水电离的c(OH-)
D. A、B、C三点溶液均有Kw=c(H+)·c(OH-)=1.0×10-14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中粒子的物质的量浓度关系正确的是( )
A.NaH2PO4溶液pH<7,则在溶液中: c(Na+)>c(H2PO4-)>c(H3PO4)>c(HPO42-)
B.0.1 mol·L-1(NH4)2SO4溶液与0.1 mol·L-1NH3·H2O溶液等体积混合:c(NH4+)+c(H+)=2c(SO42-)+c(OH-)
C.0.1 mol·L-1CH3COONa溶液与0.1 mol·L-1CH3COOH溶液等体积混合(pH<7):c(CH3COOH)>c(Na+)>c(CH3COO-)>c(H+)
D.0.2 mol·L-1NaHCO3溶液与0.1 mol·L-1Na2CO3溶液等体积混合: 2c(Na+)=3c(CO32-)+3c(HCO3-)+3c(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)①LiAlH4是有机合成中常用的还原剂,LiAlH4中的阴离子空间构型是_________、中心原子的杂化形式为________。LiAlH4中,存在_________(填标号)。
a.离子键 b.![]() 键 c.
键 c.![]() 键 d.氢键
键 d.氢键
②Li2O是离子晶体,其晶格能可通过如图的Born— Haber循环计算得到。
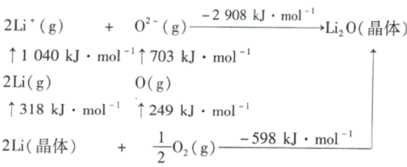
可知,Li原子的第一电离能为_________kJ·mol-1,O=O键键能为__________ kJ·mol-1,Li2O晶格能为_________ kJ·mol-1
③Li2O具有反萤石结构,晶胞如图所示。已知晶胞参数为0.465 nm,阿伏加德罗常数的值为NA,则Li2O的密度为___________g·cm-3(列出计算式)。
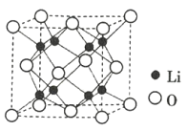
(2)金属Zn晶体中的原子堆积方式如图所示,这种堆积方式称为_______。六棱柱底边边长为a cm,高为c cm,阿伏加德罗常数的值为NA,Zn的密度为______ g·cm-3(列出计算式)。
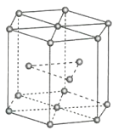
(3)FeS2晶体的晶胞如图所示。晶胞边长为a nm,FeS2相对式量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为____________g·cm-3;晶胞中Fe2+位于S22-所形成的正八面体的体心,该正八面体的边长为____________nm。
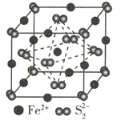
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 氨基酸在一定条件下能与亚硝酸
氨基酸在一定条件下能与亚硝酸![]() 反应得到
反应得到![]() 羟基酸,如下:
羟基酸,如下:
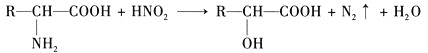
试根据如图所示关系回答下列有关问题。
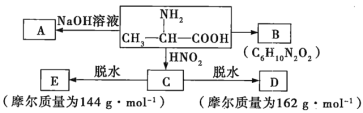
(1)写出A、B的结构简式:A_________;B_________。
(2)![]() 的化学方程式为________。
的化学方程式为________。
(3)![]() 的化学方程式为________。
的化学方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄糖酸钙是一种可促进骨骼生长的营养物质。制取葡萄糖酸钙的流程如下。
![]()
已知:a.CH2OH(CHOH)4CHO+Br2+H2O→C6H12O7(葡萄糖酸)+2HBr;
b.2C6H12O7(葡萄糖酸)+CaCO3→Ca(C6H11O7)2(葡萄糖酸钙)+H2O+CO2↑;
c.相关物质的溶解性见下表:
物质名称 | 葡萄糖酸钙 | 葡萄糖酸 | 溴化钙 | 氯化钙 |
在水中的溶解性 | 可溶于冷水,易溶于热水 | 可溶 | 易溶 | 易溶 |
在乙醇中的溶解性 | 微溶 | 微溶 | 可溶 | 可溶 |
d.酸性:盐酸>葡萄糖酸>碳酸。
请回答下列问题。
(1)制备葡萄糖酸钙涉及的反应类型有__。
(2)第①步中溴水氧化葡萄糖时,下列装置最合适的是__(填序号)。
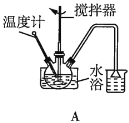
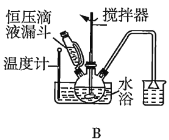
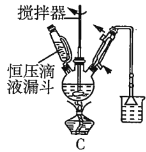
(3)第②步反应CaCO3需过量的原因是__。
(4)本实验中不宜用CaCl2替代CaCO3,理由是__。
(5)第③步需趁热过滤,其原因是__。
(6)若制备时葡萄糖溶液中含有9.0g葡萄糖,步骤⑦后得到8.2g葡萄糖酸钙,则葡萄糖酸钙的产率为__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com