
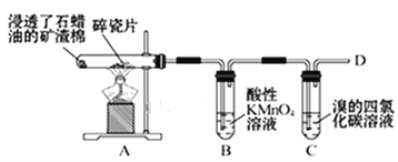
【题目】乙烯的产量通常用来衡量一个国家的石油化工水平,某化学实验小组为了探究石蜡油(17个碳以上的液态烷烃混合物)分解产物中有乙烯存在,设计了如下实验方案:
(查阅资料可知:乙烯与酸性高锰酸钾溶液反应产生二氧化碳。)
(1)乙烯的结构式是___。
(2)B中实验现象:___。
(3)C中发生反应的化学方程式:__,反应类型:___。
(4)通过上述实验探究可知,除去乙烷中混有的乙烯,可以选择的试剂是___。
A.水 B.溴水
C.氢氧化钠溶液 D.酸性高锰酸钾溶液
(5)关于乙烯,下列说法中不正确的是___。
A.聚乙烯塑料可以用做食品包装袋
B.乙烯在一定条件下可以和水反应制乙醇
C.乙烯分子中所有原子不共面
D.乙烯是一种植物生长调节剂,可以延长果实和花朵的成熟期
【答案】![]() 酸性KMnO4溶液褪色 CH2=CH2+Br2→BrCH2—CH2Br 加成反应 B CD
酸性KMnO4溶液褪色 CH2=CH2+Br2→BrCH2—CH2Br 加成反应 B CD
【解析】
装置A中给碎瓷片加强热,石蜡油蒸汽通过炽热的碎瓷片表面,分解产生乙烯等物质,乙烯含有碳碳双键可以被酸性高锰酸钾,使装置B中的酸性高锰酸钾溶液褪色,乙烯可以可以溴发生加成反应,使装置C中溴的四氯化碳溶液褪色。
(1)乙烯的结构式为![]() ;
;
(2)乙烯含有碳碳双键可以被酸性高锰酸钾,使装置B中的酸性高锰酸钾溶液褪色;
(3)C中发生乙烯与溴的加成反应,方程式为CH2=CH2+Br2→BrCH2—CH2Br;
(4)乙烷和乙烯均不能溶于水,且均不能与NaOH溶液反应;乙烷不能与溴加成,也不能被酸性高锰酸钾氧化,但是乙烯被高锰酸钾氧化会生成二氧化碳成为新的杂质,而与溴水反应可以生成常温下为液态的1,2-二溴乙烷,所以可以用溴水除去乙烷中混有的乙烯,所以选B;
(5)A.聚乙烯塑料性质稳定且无毒,可以用做食品包装袋,A正确;
B.乙烯含有碳碳双键一定条件可以与水发生加成反应生成乙醇,B正确;
C.乙烯分子中碳原子为sp2杂化,杂化轨道为平面三角形结构,所以乙烯分子中所有原子共面,C错误;
D.乙烯具有催熟作用,可以缩短果实和花朵的成熟期,D错误;
综上所述,答案为CD。


科目:高中化学 来源: 题型:
【题目】下图为氢氧燃料电池装置示意图,下列有关说法正确的是( )
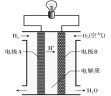
A. 电极A为正极
B. 产物为水,属于环境友好电池
C. 电子流向:电极B→导线→电极A
D. 该电池的化学能可以100%转化为电能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液中Cl-、Br-、I-的物质的量依次为0.2mol、0.4mol、0.6mol,欲使其Cl-、Br-、I-的物质的量比为1:1:1,需通入Cl2,那么通入Cl2的物质的量是原溶液中I-物质的量的之比是( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化合物和二氧化硫是引起雾霾的重要物质,工业用多种方法来治理。某种综合处理含NH4+废水和工业废气(主要含NO、CO、CO2、SO2、N2)的流程如图:
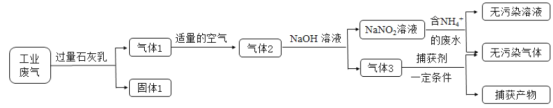
已知:NO+NO2+2NaOH=2NaNO2+H2O 2NO2+2NaOH=NaNO3+NaNO2+H2O
(1)固体1的主要成分有Ca(OH)2、__________(填化学式)。
(2)若实验室需要配制3 mol·L-1NaOH溶液1L进行模拟测试,需称取NaOH固体质量为__________g。
(3)用NaNO2溶液处理含NH4+废水反应的离子方程式为__________。
(4)验证废水中NH4+已基本除净的方法是___________(写出操作、现象与结论)。
(5)气体1转化为气体2时空气不能过量的原因是__________。
(6)捕获剂捕获的气体主要是__________(填化学式)。
(7)流程中生成的NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒。已知NaNO2能发生如下反应:2NaNO2+4HI=2NO↑+I2+2NaI+2H2O;I2可以使淀粉变蓝。根据上述反应,选择生活中常见的物质和有关试剂进行实验,以鉴别NaNO2和NaCl。需选用的物质是__________(填序号)。
①水 ②淀粉碘化钾试纸 ③淀粉 ④白酒 ⑤白醋
A.①③⑤ B.①②④ C.①②⑤ D.①②③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质互为同系物的是
①乙二醇和丙三醇
②HCOOH与CH2=CH-COOH
③CH4与C3H8
④![]() CH3与
CH3与![]()
⑤CH![]() CH与CH2=CH-CH=CH2 ⑥1-丁烯与2-甲基丙烯
CH与CH2=CH-CH=CH2 ⑥1-丁烯与2-甲基丙烯
A. ①④⑤ B. ①④⑥ C. ③ D. ④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味。实验室制备乙酸异戊酯的反应、装置示意图和有关数据如下:
![]()
项目 | 相对分子质量 | 密度/(g·cm3) | 沸点/℃ | 水中溶解性 |
异戊醇 | 88 | 0.812 3 | 131 | 微溶 |
乙酸 | 60 | 1.049 2 | 118 | 溶 |
乙酸异戊酯 | 130 | 0.867 0 | 142 | 难溶 |
![]()
实验步骤:
在A中加入4.4 g异戊醇、6.0 g乙酸、数滴浓硫酸和2~3片碎瓷片,开始缓慢加热A50 min。反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液和水洗涤;分出的产物加入少量无水MgSO4固体,静置片刻,过滤除去MgSO4固体,进行蒸馏纯化,收集140~143 ℃馏分,得乙酸异戊酯3.9 g。
回答下列问题:
(1)仪器B的作用是________________。
(2)在洗涤操作中,第一次水洗的主要目的是____________________,第二次水洗的主要目的是________________________________________。
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后________(填标号)。
a.直接将乙酸异戊酯从分液漏斗的上口倒出
b.直接将乙酸异戊酯从分液漏斗的下口放出
c.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
d.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口倒出
(4)本实验中加入过量乙酸的目的是________________________;加入少量无水MgSO4的目的是__________________。
(5)在蒸馏操作中,仪器选择及安装都正确的是________(填标号)。
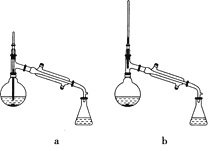
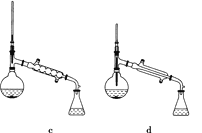
(6)在进行蒸馏操作时,若从130 ℃便开始收集馏分,会使实验的产率偏________(填“高”或“低”),其原因是_____________________________________________________。
(7)本实验的产率是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物是心血管药的主要成分,其合成线路如下:
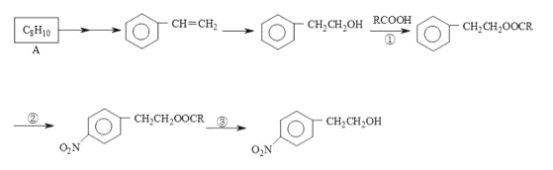
(1)A 的结构简式为____;从 A 制取苯乙烯需要经过两步,第一步是Cl2/光照,请写出第二步的化学方程式____。
(2)反应②的反应类型是__________反应。
(3)反应①③的目的是____________ 。
(4)反应③的试剂和条件是_____________ 。
(5)丁苯橡胶是常用的工业橡胶,其有苯乙烯和 1,3-丁二烯共聚得到,请写出其结构简式_______
(6)请写出 1,3-丁二烯制取 HOCH2CH2CH2CH2OH 的有机合成线路。_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:![]() (所有物质均为气体)在恒容容器中进行,达到平衡状态的标志是 ( )
(所有物质均为气体)在恒容容器中进行,达到平衡状态的标志是 ( )
① 混合气体的压强不再改变的状态
② 单位时间内生成n mol NO2的同时生成2n mol O2
③ 用NO2、NO、O2表示的反应速率之比为2:2:1的状态
④ 混合气体的颜色不再改变的状态
⑤ 混合气体的密度不再改变的状态
⑥ 混合气体的平均相对分子质量不再改变的状态
A.①④⑥B.②③⑤
C.①③④D.①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,装置在常温下工作(溶液体积变化忽略不计)。闭合K,灯泡发光。下列叙述中不正确的是

A.当电路中有1.204×1022个电子转移时,乙烧杯中溶液的c(H+)约为0.1molL-1
B.电池工作时,盐桥中的K+移向甲烧杯
C.电池工作时,外电路的电子方向是从a到b
D.乙池中的氧化产物为SO42-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com