
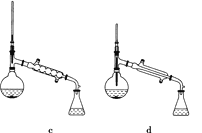
【题目】乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味。实验室制备乙酸异戊酯的反应、装置示意图和有关数据如下:
![]()
项目 | 相对分子质量 | 密度/(g·cm3) | 沸点/℃ | 水中溶解性 |
异戊醇 | 88 | 0.812 3 | 131 | 微溶 |
乙酸 | 60 | 1.049 2 | 118 | 溶 |
乙酸异戊酯 | 130 | 0.867 0 | 142 | 难溶 |
![]()
实验步骤:
在A中加入4.4 g异戊醇、6.0 g乙酸、数滴浓硫酸和2~3片碎瓷片,开始缓慢加热A50 min。反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液和水洗涤;分出的产物加入少量无水MgSO4固体,静置片刻,过滤除去MgSO4固体,进行蒸馏纯化,收集140~143 ℃馏分,得乙酸异戊酯3.9 g。
回答下列问题:
(1)仪器B的作用是________________。
(2)在洗涤操作中,第一次水洗的主要目的是____________________,第二次水洗的主要目的是________________________________________。
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后________(填标号)。
a.直接将乙酸异戊酯从分液漏斗的上口倒出
b.直接将乙酸异戊酯从分液漏斗的下口放出
c.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
d.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口倒出
(4)本实验中加入过量乙酸的目的是________________________;加入少量无水MgSO4的目的是__________________。
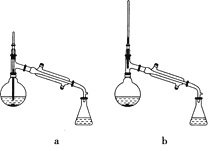
(5)在蒸馏操作中,仪器选择及安装都正确的是________(填标号)。
(6)在进行蒸馏操作时,若从130 ℃便开始收集馏分,会使实验的产率偏________(填“高”或“低”),其原因是_____________________________________________________。
(7)本实验的产率是________。
【答案】冷凝回流 洗掉大部分硫酸和乙酸 洗掉碳酸氢钠溶液 d 提高异戊醇的转化率 干燥 b 高 收集少量未反应的异戊醇 60%
【解析】
(1)仪器B为球形冷凝管,其作用是冷凝回流;
(2)在洗涤操作中,第一次洗涤的主要目的是除去大部分催化剂硫酸和醋酸;第二次水洗,主要目的是除去产品中残留的碳酸氢钠;
(3)由于酯的密度比水小,二者互不相溶,因此水在下层,酯在上层;
(4)加入过量乙酸的目的是提高转化率;加入少量无水硫酸镁的目的是吸收酯中少量的水分;
(5)根据蒸馏的装置进行分析;
(6)从130℃便开始收集馏分此时的蒸气中含有异戊醇,会收集少量的未反应的异戊醇,因此会导致产率偏高;
(7)乙酸异戊酯的产率为实际值/理论值。
(1)由装置中仪器B的构造可知,仪器B的名称为球形冷凝管,结合各物质沸点可知,其作用是冷凝回流,故答案为冷凝回流。
(2)反应后的溶液要经过多次洗涤,在洗涤操作中,第一次洗涤的主要目的是除去大部分催化剂硫酸和醋酸;用饱和碳酸氢钠溶液既可以除去未洗净的醋酸,也可以降低酯的溶解度,所以第二次水洗,主要目的是除去产品中残留的碳酸氢钠;故答案为:洗掉大部分硫酸和乙酸;洗掉碳酸氢钠溶液。
(3)由于酯的密度比水小,二者互不相溶,因此水在下层,酯在上层;分液时,要先将水层从分液漏斗的下口放出,待液体下降到两层液体界面时关闭分液漏斗的活塞,再将乙酸异戊酯从上口放出,所以正确的为d,故答案为:d。
(4)酯化反应是可逆反应,增大反应物的浓度可以使平衡正向移动;增加一种反应物的浓度,可以使另一种反应物的转化率提高,因此本实验中加入过量乙酸的目的是提高转化率;实验中加入少量无水硫酸镁的目的是吸收酯中少量的水分,对其进行干燥;故答案为:提高异戊醇的转化率;干燥。
(5)在蒸馏操作中,温度计的水银球要放在蒸馏烧瓶的支管口处,所以ad错误;c中使用的是球形冷凝管容易使产品滞留,不能全部收集到锥形瓶中,因此仪器及装置安装正确的是b,故答案为:b。
(6)在进行蒸馏操作时,若从130℃便开始收集馏分此时的蒸气中含有异戊醇,会收集少量的未反应的异戊醇,因此会导致产率偏高,故答案为:高;收集少量未反应的异戊醇。
(7)乙酸的物质的量为:n=6.0g÷60g/mol=0.1mol,异戊醇的物质的量为:n=4.4g÷88g/mol=0.05mol,由于乙酸和异戊醇是按照1:1进行反应,所以乙酸过量,生成乙酸异戊酯的量要按照异戊醇的物质的量计算,即理论上生成0.05mol乙酸异戊酯;实际上生成的乙酸异戊酯的物质的量为:3.9g÷130g/mol=0.03mol,所以实验中乙酸异戊酯的产率为:![]() ×100%=60%,故答案为:60%。
×100%=60%,故答案为:60%。


 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:
【题目】根据有机化合物的命名原则,下列命名正确的是
A.![]() 3-甲基-1,3-丁二烯
3-甲基-1,3-丁二烯
B.![]() 2-羟基丁烷
2-羟基丁烷
C.CH3CH(C2H5)CH2CH2CH3 2-乙基戊烷
D.(CH3)3CCl 2-甲基-2-氯丙烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)纯碱是一种重要的化工原料。目前制碱工业主要有“氨碱法”和“联合制碱法”两种工艺。
①“氨碱法”产生大量CaCl2废弃物,写出该工艺中产生CaCl2的化学方程式:___;
②CO2是制碱工业的重要原料,“联合制碱法”与“氨碱法”中CO2的来源有何不同?___;
(2)某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计的方案实验.①一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如图所示(图中夹持、固定用的仪器未画出)试回答下列有关问题:
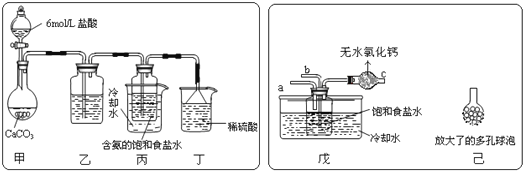
(Ⅰ)乙装置中的试剂是___;其作用是____;
(Ⅱ)丁装置中稀硫酸的作用是___;
(Ⅲ)实验结束后,分离出NaHCO3晶体的操作是___(填分离操作的名称).该操作所需是玻璃仪器有____。
②另一位同学用图中戊装置(其它装置未画出)进行实验。
(Ⅰ)实验时,须先从__(“a”或“b”)管通入___气体,说明原因___。
(Ⅱ)有同学建议在戊装置的b管下端连接己装置,理由是___。
(III)碳酸氢钠受热所得固体12.28g与足量石灰水充分反应,所得沉淀经洗涤、干燥质量为12.00g,则所得固体中碳酸钠的质量分数为:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行的反应C(s)+H2O(g)![]() CO(g)+H2(g),能使反应速率加快的措施有( )
CO(g)+H2(g),能使反应速率加快的措施有( )
①增加炭的量②升高温度③将炭粉碎④恒容通入水蒸气⑤通过减小容器体积增大压强⑥恒容通入N2
A.②③④⑤B.②③④⑤⑥C.①②③④⑤D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯的产量通常用来衡量一个国家的石油化工水平,某化学实验小组为了探究石蜡油(17个碳以上的液态烷烃混合物)分解产物中有乙烯存在,设计了如下实验方案:
(查阅资料可知:乙烯与酸性高锰酸钾溶液反应产生二氧化碳。)
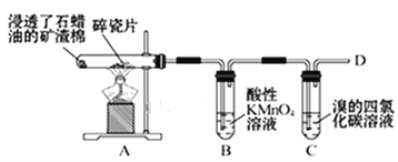
(1)乙烯的结构式是___。
(2)B中实验现象:___。
(3)C中发生反应的化学方程式:__,反应类型:___。
(4)通过上述实验探究可知,除去乙烷中混有的乙烯,可以选择的试剂是___。
A.水 B.溴水
C.氢氧化钠溶液 D.酸性高锰酸钾溶液
(5)关于乙烯,下列说法中不正确的是___。
A.聚乙烯塑料可以用做食品包装袋
B.乙烯在一定条件下可以和水反应制乙醇
C.乙烯分子中所有原子不共面
D.乙烯是一种植物生长调节剂,可以延长果实和花朵的成熟期
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某红色固体粉末样品可能含有Fe2O3和Cu2O中的一种或两种,某校化学自主探究实验小组拟对其组成进行探究。查阅资料:Cu2O在酸性溶液中会发生反应:Cu2O+2H+=Cu+Cu2++H2O。
实验探究一:学生甲利用如图所示装置进行实验,称量反应前后装置C中样品的质量,以确定样品的组成。回答下列问题:
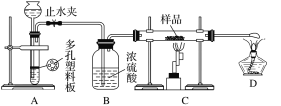
(1)仪器组装完成后,夹好止水夹,__________________________________,则说明装置A的气密性良好。
(2)下列实验步骤中,正确的操作顺序是____________(填序号)。
①打开止水夹;②熄灭C处的酒精喷灯;③C处冷却至室温后,关闭止水夹;④点燃C处的酒精喷灯;⑤收集氢气并验纯
实验探究二:
(3)学生乙取少量样品于烧杯中,加入过量稀硫酸,并作出如下假设和判断,结论正确的是 ______。
A.若固体全部溶解,说明样品中一定含有Fe2O3,一定不含有Cu2O
B.若固体部分溶解,说明样品中一定含有Cu2O,一定不含有Fe2O3
C.若固体全部溶解,再滴加KSCN溶液,溶液不变红色,说明样品一定含有Fe2O3和Cu2O
D.若固体全部溶解,再滴加KSCN溶液,溶液变红色,说明样品一定含有Fe2O3
另取少量样品于试管中,加入适量的浓硝酸,产生红棕色气体,证明样品中一定含有________,写出产生上述气体的化学方程式:____________________。
实验探究三:
(4)学生丙取一定量样品于烧杯中,加入足量的稀硫酸,反应后经过滤得到固体6.400g,测得滤液中Fe2+有2.000mol,则样品中n(Cu2O)=________________________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列中心原子的杂化轨道类型和分子立体构型不正确的是( )
A. PCl3中P原子采用sp3杂化,为三角锥形
B. BCl3中B原子采用sp2杂化,为平面三角形
C. CS2中C原子采用sp杂化,为直线形
D. H2S中S原子采用sp杂化,为直线形
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产中常用MnS作为沉淀剂除去工业废水中Cu2+:Cu2+(aq)+MnS(s)=CuS(s)+Mn2+(aq),下列说法不正确的是( )
A. 该反应达平衡时c(Mn2+)=c(Cu2+)
B. 该反应的平衡常数K= Ksp(MnS)/ Ksp(CuS)
C. 往平衡体系中加入少量CuSO4固体后,c(Mn2+)变大
D. MnS的Ksp比CuS的Ksp大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家最近在-100℃的低温下合成了一种烃X,X分子中所有氢原子的化学环境没有区别,其球棍模型如图。下列说法中不正确的是

A. X的分子式为C5H4
B. X分子中有碳碳单键,也有碳碳双键
C. 该烃X与等质量的甲烷相比,X燃烧时消耗的氧气更多
D. X分子中的氢原子分布在两个相互垂直的异面直线上
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com