
【题目】下列中心原子的杂化轨道类型和分子立体构型不正确的是( )
A. PCl3中P原子采用sp3杂化,为三角锥形
B. BCl3中B原子采用sp2杂化,为平面三角形
C. CS2中C原子采用sp杂化,为直线形
D. H2S中S原子采用sp杂化,为直线形
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】卤素单质可以参与很多化学反应, 如:NF3气体可由NH3和F2在Cu催化剂存在下反应直接得到;反应①:2NH3+3F2![]() NF3+ 3NH4F,Ta(钽)是一种过渡元素,利用“化学蒸气转移法”可以制备TaS2晶体;反应②:TaI4(g)+S2(g)
NF3+ 3NH4F,Ta(钽)是一种过渡元素,利用“化学蒸气转移法”可以制备TaS2晶体;反应②:TaI4(g)+S2(g)![]() TaS2(s)+2I2(g)+QkJ,Q>0
TaS2(s)+2I2(g)+QkJ,Q>0
(1)反应①中:非金属性最强的元素原子核外有____种不同运动状态的电子;该反应中的某元素的单质可作粮食保护气,则该元素最外层的电子有___种自旋方向。
(2)反应①中:物质所属的晶体类型有____;并写出所有原子符合8电子稳定结构的化合物的电子式____。
(3)反应②中:平衡常数表达式:K=___,若反应达到平衡后,保持其他条件不变,降低温度,重新达到平衡时____。
a.平衡常数K增大 b. S2的浓度减小 c. I2的质量减小 d. V(TaI4)逆 增大
(4)反应②在一定温度下进行,若反应容器的容积为2L,3min后达到平衡,测得蒸气的质量减少了2.45g,则I2的平均反应速率为___。
(5)某同学对反应②又进行研究,他查阅资料,发现硫单质有多种同素异形体,可表示Sx(x为偶数),且在一定条件下可以相互转化,他认为仅增大压强对平衡是有影响的,则TaI4的平衡转化率会____(填增大或减小),其原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化合物和二氧化硫是引起雾霾的重要物质,工业用多种方法来治理。某种综合处理含NH4+废水和工业废气(主要含NO、CO、CO2、SO2、N2)的流程如图:
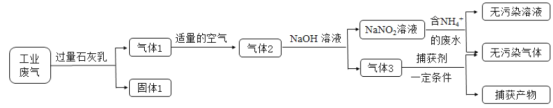
已知:NO+NO2+2NaOH=2NaNO2+H2O 2NO2+2NaOH=NaNO3+NaNO2+H2O
(1)固体1的主要成分有Ca(OH)2、__________(填化学式)。
(2)若实验室需要配制3 mol·L-1NaOH溶液1L进行模拟测试,需称取NaOH固体质量为__________g。
(3)用NaNO2溶液处理含NH4+废水反应的离子方程式为__________。
(4)验证废水中NH4+已基本除净的方法是___________(写出操作、现象与结论)。
(5)气体1转化为气体2时空气不能过量的原因是__________。
(6)捕获剂捕获的气体主要是__________(填化学式)。
(7)流程中生成的NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒。已知NaNO2能发生如下反应:2NaNO2+4HI=2NO↑+I2+2NaI+2H2O;I2可以使淀粉变蓝。根据上述反应,选择生活中常见的物质和有关试剂进行实验,以鉴别NaNO2和NaCl。需选用的物质是__________(填序号)。
①水 ②淀粉碘化钾试纸 ③淀粉 ④白酒 ⑤白醋
A.①③⑤ B.①②④ C.①②⑤ D.①②③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
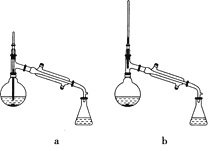
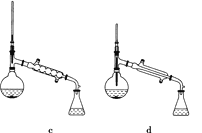
【题目】乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味。实验室制备乙酸异戊酯的反应、装置示意图和有关数据如下:
![]()
项目 | 相对分子质量 | 密度/(g·cm3) | 沸点/℃ | 水中溶解性 |
异戊醇 | 88 | 0.812 3 | 131 | 微溶 |
乙酸 | 60 | 1.049 2 | 118 | 溶 |
乙酸异戊酯 | 130 | 0.867 0 | 142 | 难溶 |
![]()
实验步骤:
在A中加入4.4 g异戊醇、6.0 g乙酸、数滴浓硫酸和2~3片碎瓷片,开始缓慢加热A50 min。反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液和水洗涤;分出的产物加入少量无水MgSO4固体,静置片刻,过滤除去MgSO4固体,进行蒸馏纯化,收集140~143 ℃馏分,得乙酸异戊酯3.9 g。
回答下列问题:
(1)仪器B的作用是________________。
(2)在洗涤操作中,第一次水洗的主要目的是____________________,第二次水洗的主要目的是________________________________________。
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后________(填标号)。
a.直接将乙酸异戊酯从分液漏斗的上口倒出
b.直接将乙酸异戊酯从分液漏斗的下口放出
c.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
d.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口倒出
(4)本实验中加入过量乙酸的目的是________________________;加入少量无水MgSO4的目的是__________________。
(5)在蒸馏操作中,仪器选择及安装都正确的是________(填标号)。
(6)在进行蒸馏操作时,若从130 ℃便开始收集馏分,会使实验的产率偏________(填“高”或“低”),其原因是_____________________________________________________。
(7)本实验的产率是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物是心血管药的主要成分,其合成线路如下:
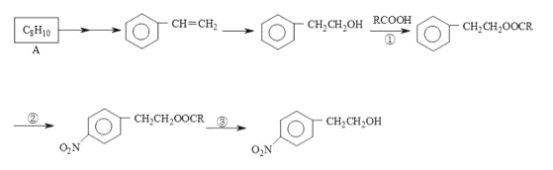
(1)A 的结构简式为____;从 A 制取苯乙烯需要经过两步,第一步是Cl2/光照,请写出第二步的化学方程式____。
(2)反应②的反应类型是__________反应。
(3)反应①③的目的是____________ 。
(4)反应③的试剂和条件是_____________ 。
(5)丁苯橡胶是常用的工业橡胶,其有苯乙烯和 1,3-丁二烯共聚得到,请写出其结构简式_______
(6)请写出 1,3-丁二烯制取 HOCH2CH2CH2CH2OH 的有机合成线路。_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D 均为短周期主族元素,且原子序数一次递增。A 是地壳中含量最多的元素, B 是短周期中金属性最强的元素,C 与 D 位置相邻,D 是同周期元素中原子半径最小的元素。完成下列填空:
(1)A 在周期表中的位置为第____周期______族,A 原子的最外层电子排布式为____,A 原子核外共有____个不同运动状态的电子。
(2)B、C、D 三种元素形成简单离子其半径大小的____________。(用个离子符号表示)
(3) A、B 形成化合物的电子式____;这些化合物中所含的化学键有____
(4)非金属性的强弱:C______D(填“强于”、“弱于”、“无法比较”),试从原子结构的角度解释其原因。_____请用一个方程式证明 A 与 C 的非金属性的强弱____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:![]() (所有物质均为气体)在恒容容器中进行,达到平衡状态的标志是 ( )
(所有物质均为气体)在恒容容器中进行,达到平衡状态的标志是 ( )
① 混合气体的压强不再改变的状态
② 单位时间内生成n mol NO2的同时生成2n mol O2
③ 用NO2、NO、O2表示的反应速率之比为2:2:1的状态
④ 混合气体的颜色不再改变的状态
⑤ 混合气体的密度不再改变的状态
⑥ 混合气体的平均相对分子质量不再改变的状态
A.①④⑥B.②③⑤
C.①③④D.①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组利用下面的装置进行实验,②、③中溶液均足量,操作和现象如下表。
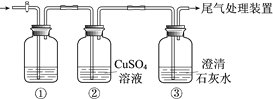
实验 | 操作 | 现象 |
Ⅰ | 向盛有Na2S溶液的①中持续通入CO2至过量 | ②中产生黑色沉淀,溶液的pH降低; ③中产生白色浑浊,该浑浊遇酸冒气泡 |
Ⅱ | 向盛有NaHCO3溶液的①中持续通入H2S气体至过量 | 现象同实验Ⅰ |
资料:CaS遇水完全水解
由上述实验得出的结论不正确的是
A. ③中白色浑浊是CaCO3
B. ②中溶液pH降低的原因是:H2S+Cu2+ == CuS↓+2H+
C. 实验Ⅰ①中CO2过量发生的反应是:CO2+H2O+ S2== CO32+ H2S
D. 由实验Ⅰ和Ⅱ不能比较H2CO3和H2S酸性的强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中的实线表示元素周期表的部分边界。

(1)请在上表中用实线补出元素周期表的上边界。_____________
(2)某主族元素原子的核外电子排布为: ,该元素在元素周期表中的位置为_______________。
,该元素在元素周期表中的位置为_______________。
(3)元素I的非金属性________(填“强于”或“弱于”)元素H,用原子结构的观点解释原因:同周期元素随着原子序数的递增,______________________,非金属性增强。设计实验证明元素E的金属性强于元素F:_______________________________________。
(4)处于周期表中对角线位置(左上方和右下方) 的元素,其性质具有相似性,称为“对角线规则”。元素D与F的单质及其化合物性质相似,如D、DO、D(OH)2与NaOH溶液都能反应生成Na2DO2等物质。回答下列问题。
①写出F的单质与氢氧化钠溶液反应的离子方程式___________________________。
②鉴别元素D与E的氢氧化物可用试剂是_________________。
(5)元素G的一种含氧酸化学式为:H3GO3,其结构式可表示为: ,请写出该酸与过量氢氧化钠溶液反应的化学方程式_________________________________。
,请写出该酸与过量氢氧化钠溶液反应的化学方程式_________________________________。
信息:氢氧原子结合成的一种原子团“—OH”叫羟基,含氧酸中羟基氢方可电离出H+。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com