
【题目】某小组利用下面的装置进行实验,②、③中溶液均足量,操作和现象如下表。
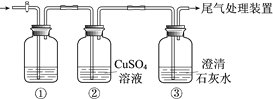
实验 | 操作 | 现象 |
Ⅰ | 向盛有Na2S溶液的①中持续通入CO2至过量 | ②中产生黑色沉淀,溶液的pH降低; ③中产生白色浑浊,该浑浊遇酸冒气泡 |
Ⅱ | 向盛有NaHCO3溶液的①中持续通入H2S气体至过量 | 现象同实验Ⅰ |
资料:CaS遇水完全水解
由上述实验得出的结论不正确的是
A. ③中白色浑浊是CaCO3
B. ②中溶液pH降低的原因是:H2S+Cu2+ == CuS↓+2H+
C. 实验Ⅰ①中CO2过量发生的反应是:CO2+H2O+ S2== CO32+ H2S
D. 由实验Ⅰ和Ⅱ不能比较H2CO3和H2S酸性的强弱
【答案】C
【解析】
实验Ⅰ.向①的Na2S溶液中持续通入CO2至过量,②中产生黑色沉淀,溶液的pH降低,说明生成了硫化氢气体,同时生成了硫酸;③中产生白色浑浊,该浑浊遇酸冒气泡,说明二氧化碳过量,被氢氧化钙溶液吸收生成了碳酸钙沉淀;
实验Ⅱ. 向盛有NaHCO3溶液的①中持续通入H2S气体至过量,②中产生黑色沉淀,溶液的pH降低,是因为过量的硫化氢气体与硫酸铜溶液反应生成了CuS黑色沉淀,同时生成了硫酸;③中产生白色浑浊,该浑浊遇酸冒气泡,说明反应生成了二氧化碳,被氢氧化钙溶液吸收生成了碳酸钙沉淀;据此分析解答。
A. 根据上述分析,③中白色浑浊是CaCO3,不可能是CaS,因为CaS遇水完全水解,故A正确;
B. ②中反应生成的硫化氢或过量的硫化氢与硫酸铜反应, H2S+Cu2+ = CuS↓+2H+,使得溶液的pH降低,故B正确;
C. CO2过量反应生成2HCO3,发生的反应是:2CO2+2H2O+ S2=2HCO3+ H2S,故C错误;
D. 根据实验Ⅰ、Ⅱ中现象:Ⅰ中通二氧化碳有H2S生成,Ⅱ中通H2S有二氧化碳生成,不能比较H2CO3和H2S酸性的强弱,故D正确;
答案选C。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】(1)纯碱是一种重要的化工原料。目前制碱工业主要有“氨碱法”和“联合制碱法”两种工艺。
①“氨碱法”产生大量CaCl2废弃物,写出该工艺中产生CaCl2的化学方程式:___;
②CO2是制碱工业的重要原料,“联合制碱法”与“氨碱法”中CO2的来源有何不同?___;
(2)某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计的方案实验.①一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如图所示(图中夹持、固定用的仪器未画出)试回答下列有关问题:
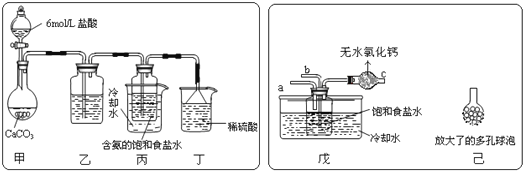
(Ⅰ)乙装置中的试剂是___;其作用是____;
(Ⅱ)丁装置中稀硫酸的作用是___;
(Ⅲ)实验结束后,分离出NaHCO3晶体的操作是___(填分离操作的名称).该操作所需是玻璃仪器有____。
②另一位同学用图中戊装置(其它装置未画出)进行实验。
(Ⅰ)实验时,须先从__(“a”或“b”)管通入___气体,说明原因___。
(Ⅱ)有同学建议在戊装置的b管下端连接己装置,理由是___。
(III)碳酸氢钠受热所得固体12.28g与足量石灰水充分反应,所得沉淀经洗涤、干燥质量为12.00g,则所得固体中碳酸钠的质量分数为:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列中心原子的杂化轨道类型和分子立体构型不正确的是( )
A. PCl3中P原子采用sp3杂化,为三角锥形
B. BCl3中B原子采用sp2杂化,为平面三角形
C. CS2中C原子采用sp杂化,为直线形
D. H2S中S原子采用sp杂化,为直线形
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产中常用MnS作为沉淀剂除去工业废水中Cu2+:Cu2+(aq)+MnS(s)=CuS(s)+Mn2+(aq),下列说法不正确的是( )
A. 该反应达平衡时c(Mn2+)=c(Cu2+)
B. 该反应的平衡常数K= Ksp(MnS)/ Ksp(CuS)
C. 往平衡体系中加入少量CuSO4固体后,c(Mn2+)变大
D. MnS的Ksp比CuS的Ksp大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝广泛应用于电子陶瓷等工业领域。在一定条件下,AlN可通过反应:Al2O3+N2+3C![]() 2AlN+3CO合成。下列叙述正确的是
2AlN+3CO合成。下列叙述正确的是
A. AlN中氮的化合价为+3B. 上述反应中,每生成1 mol AlN需转移3 mol电子
C. AlN的摩尔质量为41 gD. 上述反应中,N2是还原剂,Al2O3是氧化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T1时,将气体X和气体Y各1.6mol充入10L恒容密闭容器中,发生反应X(g)+Y(g)![]() 2Z(g),一段时间后达到平衡。反应过程中测定的数据如表:下列说法正确的是
2Z(g),一段时间后达到平衡。反应过程中测定的数据如表:下列说法正确的是
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 1.2 | 1.1 | 1.0 | 1.0 |
A. 反应0~4 min的平均速率υ(Z)=0.25 mol/(Lmin)
B. T1时,反应的平衡常数K1=1.2
C. 其他条件不变,9 min后,向容器中再充入1.6 molX,平衡向正反应方向移动,再次达到平衡时X的浓度减小,Y的转化率增大
D. 其他条件不变,降温到T2达到平衡时,平衡常数K2=4,则此反应的△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增大。m、p、q、r、s是由这些元素组成的二元化合物,常温常压下r为液体,其余均为无色气体。m的摩尔质量为p的2倍,n是Y元素的单质,是绿色植物光合作用产生的无色气体,p物质能使湿润的红色石蕊试纸变蓝,q能使品红溶液褪色。上述物质的转化关系如图所示。下列说法正确的是( )

A. q与s均为酸性氧化物B. Z的含氧酸是一种强酸
C. X、Y分别与W形成10e-的微粒能反应生成一种气体D. 原子半径:W<Y<X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家最近在-100℃的低温下合成了一种烃X,X分子中所有氢原子的化学环境没有区别,其球棍模型如图。下列说法中不正确的是

A. X的分子式为C5H4
B. X分子中有碳碳单键,也有碳碳双键
C. 该烃X与等质量的甲烷相比,X燃烧时消耗的氧气更多
D. X分子中的氢原子分布在两个相互垂直的异面直线上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.1 mol甲醇分子中含有的共价键数为4NA
B.2.4 g镁在足量的氧气中燃烧,转移的电子数为0.1NA
C.标准状况下,5.6 L二氧化碳气体中含有的氧原子数为0.5NA
D.1 L 0.5 mol/L CH3COONa溶液中含有的CH3COO-数为0.5NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com