
【题目】短周期元素W、X、Y、Z的原子序数依次增大。m、p、q、r、s是由这些元素组成的二元化合物,常温常压下r为液体,其余均为无色气体。m的摩尔质量为p的2倍,n是Y元素的单质,是绿色植物光合作用产生的无色气体,p物质能使湿润的红色石蕊试纸变蓝,q能使品红溶液褪色。上述物质的转化关系如图所示。下列说法正确的是( )

A. q与s均为酸性氧化物B. Z的含氧酸是一种强酸
C. X、Y分别与W形成10e-的微粒能反应生成一种气体D. 原子半径:W<Y<X
【答案】D
【解析】
短周期元素W、X、Y、Z的原子序数依次增加,m、p、q、r、s是由这些元素组成的二元化合物,常温常压下r为液体,则r应为H2O,其余均为无色气体,n是元素Y的单质,是绿色植物光合作用产生的无色气体,则Y为O元素,n为O2,p物质能使湿润的红色石蕊试纸变蓝,则p为NH3,所以W应为H元素,X应为N元素,根据转化关系,氨气和氧气在催化剂作用下生成r和s,所以s为NO,m的摩尔质量为p的2倍,m应为H2S,q能使品红溶液褪色,q应为SO2,所以Z应为S元素,硫化氢在氧气中燃烧生成SO2和H2O,符合转化关系,结合元素周期律解答。
A.q为SO2,SO2和碱反应生成盐和水,属于酸性氧化物,s为NO不能和碱反应,不是酸性氧化物,A错误;
B.Z的含氧酸中,硫酸是一种强酸,而亚硫酸为弱酸,B错误;
C.W是H,X是N,Y是O,N、O与H元素形成的10e-的微粒分别是NH3、H2O,二者反应产生NH3H2O,不能反应产生气体,C错误;
D.原子核外电子层数越多,原子半径越大,同周期元素自左而右原子半径减小,原子半径W(H)<Y(O)<X(N),D正确;
故合理选项是D。


 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案科目:高中化学 来源: 题型:
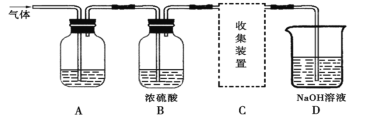
【题目】学生研究性学习小组设计实验,用于制取SO2并探究SO2的某些性质。制取SO2反应的化学方程式为:Na2SO3+2H2SO4→Na2SO4+SO2↑+H2O,产生的气体通入如图所示装置:
(实验探究)
(1)将12.6g的Na2SO3与足量的浓硫酸反应可制得SO2的体积为___________L(标准状况),该制取SO2的反应________(选填“是”或“不是”)氧化还原反应。
(2)若用A装置检验SO2具有漂白性,则A中的溶液是_________。
若用A装置检验SO2是一种酸性氧化物,则A中的溶液是_________。
(3)D装置中发生的反应是(写化学方程式):____________________________________。
(实验讨论)
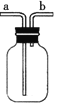
(4)对如图中的C处,甲、乙两同学都选用如图装置,但对连接方式持有不同意见。甲同学认为:SO2气体应从a处通入集气瓶中。乙同学认为:SO2气体应从b处通入集气瓶中。你认为________(填“甲”或“乙”)同学的看法是正确的。
(联系实际)
(5)SO2对环境的影响较大,为了减少SO2对空气的污染,请你从工业生产的角度提出一种有效可行的措施(用文字表述):________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼氢化钠(NaBH4)在有机合成、化工生产方面有广泛应用。制备硼氢化钠的化学方程式为NaBO2+2SiO2+4Na+2H2![]() NaBH4+2Na2SiO3。下列有关上述反应的说法错误的是( )
NaBH4+2Na2SiO3。下列有关上述反应的说法错误的是( )
A. 氧化产物和还原产物的物质的量之比为2:1
B. 转移4 mol电子时,只需向装置中通入44.8 L H2(标准状况)
C. 装药品之前加热装置至100℃并持续一会儿
D. 制备硼氢化钠的副产物可能有NaH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个固定容积的密闭容器中,保持一定温度进行如下反应:H2(g)+Br2(g)![]() 2HBr(g),已知加入1 mol H2和2 mol Br2达到平衡后,生成x mol HBr,在相同条件下若起始时加入的H2、Br2、HBr分别为a、b、c(均不为0)且保持平衡时,各组分含量都不变,以下推断正确的是( )
2HBr(g),已知加入1 mol H2和2 mol Br2达到平衡后,生成x mol HBr,在相同条件下若起始时加入的H2、Br2、HBr分别为a、b、c(均不为0)且保持平衡时,各组分含量都不变,以下推断正确的是( )
①a、b、c应满足的关系是4a+c=2b
②平衡时HBr为ax mol
③a、b、c应满足的关系是a+b=c
④平衡时HBr为x mol
A. ① B. ①② C. ①④ D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以CO为原料生产二甲醚的反应为:3H2(g)+3CO(g) ![]() CH3OCH3(g)+CO2(g) △H=a kJmol-1 T℃时,起始时在恒容密闭容器中加入一定量的H2和CO,实验内容和结果如下表和下图所示。
CH3OCH3(g)+CO2(g) △H=a kJmol-1 T℃时,起始时在恒容密闭容器中加入一定量的H2和CO,实验内容和结果如下表和下图所示。
实验 序号 | 容器 体积 | 起始物质的量 | 达平衡时 放出热量 | |
H2 | CO | |||
Ⅰ | 2L | 8mol | 8mol | 494 kJ |
Ⅱ | 2L | 4mol | 4mol | —— |

(1)上述反应平衡常数K的表达式为_____。
(2)由题意可知,a=______,b________1(填“>”、“<”或“=”)。
(3)实验Ⅰ中,反应前10 min内的平均速率v(H2)=_____。
(4)下列条件能使上述反应的反应速率增大,且平衡向正反应方向移动的是______ (填写序号字母)。
a.及时分离出CH3OCH3气体b.保持容器的容积不变,再充入1 mol CO和1 mol H2
c.适当升高温度 d.保持容器的容积不变,充入1 mol 氦气
(5)T℃时,若容器中含1 molL-1 H2、2 molL-1 CO、2 molL-1 CH3OCH3、3 molL-1 CO2,则此时v正________v逆(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量的Fe、FeO、Fe2O3的混合物中加入100mL浓度为1.0mol·L-1的盐酸,恰好使混合物完全溶解,有气体放出,所得溶液中加入KSCN溶液后无红色出现。若用足量的CO在高温下还原相同质量此混合物,能得到铁的质量是( )
A. 11.2g B. 5.6g
C. 2.8g D. 1.4g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017 年世界地球日我国的主题为“节约集约利用资源,倡导绿色简约生活”。下列做法和导向不应提倡的是
A. 塞罕坝人在沙漠植树造林 B. 绿水青山就是金山银山
C. 对商品豪华包装促进销售 D. 我市的蓝天白云工程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】稠环芳香烃是指两个或两个以上的苯环通过共用环边所构成的多环有机化合物,它们的化学性质与苯相似。常见的稠环芳香烃如萘、蒽、菲、芘等,其结构分别为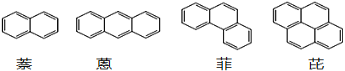
下列说法不正确的是
A. 萘的分子式为C10H8,与H2完全加成后,产物的分子式为C10H18
B. 上述四种物质均能发生取代反应、加成反应、氧化反应
C. 上述四种物质均能与液溴在铁粉催化下发生加成反应
D. 上述四种物质均可与浓硝酸发生硝化反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com