
【题目】在一个固定容积的密闭容器中,保持一定温度进行如下反应:H2(g)+Br2(g)![]() 2HBr(g),已知加入1 mol H2和2 mol Br2达到平衡后,生成x mol HBr,在相同条件下若起始时加入的H2、Br2、HBr分别为a、b、c(均不为0)且保持平衡时,各组分含量都不变,以下推断正确的是( )
2HBr(g),已知加入1 mol H2和2 mol Br2达到平衡后,生成x mol HBr,在相同条件下若起始时加入的H2、Br2、HBr分别为a、b、c(均不为0)且保持平衡时,各组分含量都不变,以下推断正确的是( )
①a、b、c应满足的关系是4a+c=2b
②平衡时HBr为ax mol
③a、b、c应满足的关系是a+b=c
④平衡时HBr为x mol
A. ① B. ①② C. ①④ D. ②③
【答案】C
【解析】
在容器中加入1 mol H2和2 mol Br2达到平衡后,生成x mol HBr,在相同条件下若起始时加入的H2、Br2、HBr分别为a、b、c(均不为0),达到平衡时,各组分含量都不变,则建立的是等效平衡;由于该反应是气体体积不变的反应,将所有量按照反应转化成氢气和溴,只要满足n(H2):n(Br2)=1:2即可。据此解答。
①根据极限转化的思想,将c mol的HBr极限转化为反应物,要实现等效平衡的建立,则相当于的投料符合:氢气:a+0.5c=1,溴单质:b+0.5c=2,整理得到:4a+c=2b,①正确;
②反应两边气体的体积不变,在容器中充入1molH2和2molBr2达到平衡后气体的物质的量还是3mol,则溴化氢的百分含量为![]() ,加入H2、Br2、HBr分别为a mol、b mol、c mol(均不为0),达到平衡时溴化氢的百分含量不变,则达到平衡时HBr物质的量为
,加入H2、Br2、HBr分别为a mol、b mol、c mol(均不为0),达到平衡时溴化氢的百分含量不变,则达到平衡时HBr物质的量为![]() ,②错误;
,②错误;
③根据①可知4a+c=2b,所以a+b不一定等于c,③错误;
④根据②中分析可知④正确;
根据以上分析可知,正确的为①④,答案选C。


科目:高中化学 来源: 题型:
【题目】实验室用密度为1.18g/ml,质量分数为36.5%浓盐酸配制250ml0.1mol/L的盐酸溶液,填空并请回答下列问题:
(1)配制250ml0.1mol/L的盐酸溶液.应量取盐酸体积_________ml,应选用容量瓶的规格__________________ml。
(2)配制时,其正确的操作顺序是________。
A.用30ml水洗涤烧杯 2﹣3次,洗涤液均注入容量瓶,振荡
B.用量筒量准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30ml),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入250ml的容量瓶中
D.将容量瓶盖紧、振荡、摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1﹣2cm处
a.BCAFED b.BCFED c.BCAED
(3)操作B中,使用量筒量取液体时视线俯视会造成配制液体浓度__________(偏高、偏低或无影响)。操作E中加水超过刻度线该如何处理?____________
(4)若出现如下情况,对所配溶液浓度将有何影响(偏高、偏低或无影响)?
a.没有进行A操作____________;
b.加蒸馏水时不慎超过了刻度___________;
c.定容时俯视_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用![]() 高能原子轰击
高能原子轰击![]() 的靶子,使锌核与铅核熔合,生成一个112号元素的原子的同时向外释放出一个中子。下列说法错误的是
的靶子,使锌核与铅核熔合,生成一个112号元素的原子的同时向外释放出一个中子。下列说法错误的是
A. 112号元素的相对原子质量为277
B. 此变化不属于化学变化
C. 科学家合成的112号元素是金属元素
D. 112号元素位于第七周期第ⅡB族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于各图像的解释或结论正确的是
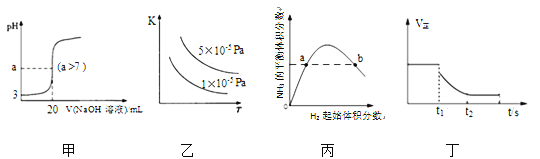
A. 图甲表示常温下向20mL pH=3的醋酸溶液中滴加pH=11的NaOH溶液,溶液的pH随NaOH溶液体积的变化关系
B. 图乙表示2SO2(g)+O2(g)![]() 2SO3(g) △H<0的平衡常数K与温度和压强的关系
2SO3(g) △H<0的平衡常数K与温度和压强的关系
C. 图丙表示一定条件下的合成氨反应,N2的起始量恒定时,NH3的平衡体积分数随H2起始体积分数的变化,图中a点N2的转化率等于b点
D. 图丁表示反应 2SO2+O2 ![]() 2SO3,t1 时刻降低温度符合图示变化
2SO3,t1 时刻降低温度符合图示变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正确认识和使用电池有利于我们每一个人的日常生活。
I.电化学法处理SO2是目前研究的热点。利用双氧水氧化吸收SO2可消除SO2污染,设计装置如图所示(己知石墨只起导电作用,质子交换膜只允许H+通过)。

(1)石墨1为____(填“正极”或“负极”),正极的电极反应式为______。
(2)反应的总方程式为_______。
(3)H+的迁移方向为由_____到____。(填“左”或“右”)
(4)若11.2L(标准状况)SO2参与反应,则迁移H+的物质的量为____。
(5)某同学关于原电池的笔记中,不合理的有____。
①原电池两电极材料活泼性一定不同
②原电池负极材料参与反应,正极材料都不参与反应
③Fe-NaOH溶液-Si原电池,Fe是负极
④原电池是将化学能转变为电能的装置
Ⅱ.航天技术中使用的氢氧燃料电池具有高能、轻便和不污染环境等优点。氢氧燃料电池有多种。
(1)某碱式氢氧燃料电池的电解质溶液是KOH溶液,则其负极反应为_____ ;某熔盐氢氧燃料电池的电解质是熔融的碳酸钾,则其负极反应为_____。
(2)氢氧燃料电池用于航天飞船,电极反应产生的水,经过冷凝后可用作航天员的饮用水,当得到1.8g饮用水时,转移的电子数约为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体内有20多种微量元素,它们的质量总和不到体重的千万分之一,但是对人的健康却起着重要的作用,下列各组元素全部是微量元素的是
A. Na、K、Cl B. Mn、Fe、B
C. N、Mg、Mo D. Mo、Ca、Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增大。m、p、q、r、s是由这些元素组成的二元化合物,常温常压下r为液体,其余均为无色气体。m的摩尔质量为p的2倍,n是Y元素的单质,是绿色植物光合作用产生的无色气体,p物质能使湿润的红色石蕊试纸变蓝,q能使品红溶液褪色。上述物质的转化关系如图所示。下列说法正确的是( )

A. q与s均为酸性氧化物B. Z的含氧酸是一种强酸
C. X、Y分别与W形成10e-的微粒能反应生成一种气体D. 原子半径:W<Y<X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极 a常用掺有石墨烯的S8材料,电池反应为:16Li+xS8=8Li2Sx(2≤x≤8)。下列说法错误的是( )

A. 电池工作时,正极可发生反应:2Li2S6+2Li++2e-=3Li2S4
B. 电池工作时,外电路中流过 0.02 mol 电子,负极材料减重 0.14 g
C. 石墨烯的作用主要是提高电极a的导电性
D. 电池充电时间越长,电池中Li2S2的量越多
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com