
【题目】人体内有20多种微量元素,它们的质量总和不到体重的千万分之一,但是对人的健康却起着重要的作用,下列各组元素全部是微量元素的是
A. Na、K、Cl B. Mn、Fe、B
C. N、Mg、Mo D. Mo、Ca、Cu
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 化学反应除了生成新物质外,还伴随着能量的变化
B. 物质燃烧和中和反应均放出热量
C. 分解反应肯定是吸热反应
D. 化学反应是吸热还是放热决定于生成物具有的总能量和反应物具有的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为探究元素周期表中元素性质的递变规律,设计了如下实验。
Ⅰ.(1)将钠、钾、镁、铝各1mol分别投入到足量的同浓度的盐酸中,试预测实验结果:_____与盐酸反应最剧烈;____与盐酸反应产生的气体最多。
(2)向Na2S溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为____。
(3)用电子式表示次氯酸形成过程______。
Ⅱ.利用如图装置可验证同主族元素非金属性的变化规律

(1)仪器D的名称为_____,其作用为___。
(2)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4,C中加淀粉碘化钾混合溶液,观察到C中溶液____(填现象),即可证明。从环境保护的观点考虑,此装置缺少尾气处理装置,用离子方程式表示该尾气吸收原理______。
(3)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液,观察到C中溶液_____(填现象),即可证明。但有的同学认为盐酸具有挥发性,可进入C中干扰试验,应在两装置间添加装有____的洗气瓶。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个固定容积的密闭容器中,保持一定温度进行如下反应:H2(g)+Br2(g)![]() 2HBr(g),已知加入1 mol H2和2 mol Br2达到平衡后,生成x mol HBr,在相同条件下若起始时加入的H2、Br2、HBr分别为a、b、c(均不为0)且保持平衡时,各组分含量都不变,以下推断正确的是( )
2HBr(g),已知加入1 mol H2和2 mol Br2达到平衡后,生成x mol HBr,在相同条件下若起始时加入的H2、Br2、HBr分别为a、b、c(均不为0)且保持平衡时,各组分含量都不变,以下推断正确的是( )
①a、b、c应满足的关系是4a+c=2b
②平衡时HBr为ax mol
③a、b、c应满足的关系是a+b=c
④平衡时HBr为x mol
A. ① B. ①② C. ①④ D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空气污染问题日益引起全民关注。
(1)汽车尾气中存在大量的CO、NO、NO2和碳氢化合物,可采用铂等贵金属作为催化剂,使CO和NO转化为无毒的气体,请写出其化学方程式____________________________
(2)科研工作者研究出利用石灰乳除工业燃煤尾气中的硫(SO2、SO3)和氮(NO、NO2)的新工艺,既能净化尾气,又能获得应用广泛的CaSO4和Ca(NO3)2。

①硫酸型酸雨的形成过程是大气中的SO2溶于雨水生成某种弱酸,在空气中经催化氧化生成硫酸,该过程中反应的化学方程式为____________________________、 ______________________________
②CaSO4可以调节水泥的硬化时间。尾气中SO2与石灰乳反应生成CaSO4的化学方程式为___________________________
③Ca(NO3)2可制成混凝土防冻剂、钢筋阻锈剂等.尾气中NO、NO2与石灰乳反应生成Ca(NO3)2的化学方程式___________________________
(3)还可用NaClO2溶液(溶液呈碱性)作为吸收剂,对含有SO2和NOX的燃煤烟气进行脱硫、脱硝。(已知:酸性条件下,ClO2-会转化成ClO2和Cl-。ClO2是黄绿色、易溶于水的气体,具有强氧化性,能氧化SO2或NOX)在鼓泡反应期中通入含SO2和NO的烟气,反应温度为323K,NaClO2溶液的浓度为5×10-3mol·L-1。反应一段时间后溶液中离子浓度的分析结果如下表。

①写出NaClO2溶液脱硝过程中主要反应的离子方程式_____________________________。增加压强,NO的转化率_______(填“提高”、“不变”或“降低”)。
②随着吸收反应的进行,吸收剂溶液的pH逐渐__________(填“提高”、“不变”或“减小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量的Fe、FeO、Fe2O3的混合物中加入100mL浓度为1.0mol·L-1的盐酸,恰好使混合物完全溶解,有气体放出,所得溶液中加入KSCN溶液后无红色出现。若用足量的CO在高温下还原相同质量此混合物,能得到铁的质量是( )
A. 11.2g B. 5.6g
C. 2.8g D. 1.4g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组同学利用下图所示装置(夹持及加热装置已略去,装置气密性良好)探究SO2的性质(实验前已事先除去装置中的空气)。请回答下列问题:
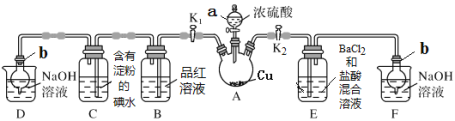
[查阅资料得知浓硫酸的沸点为338 ℃,酒精灯火焰的温度为400~500 ℃]
(1)仪器a的名称_________。
(2)装置D和F的作用是_________。
(3)加热时,装置A中反应的化学方程式为________。
(4)打开K1,关闭K2,加热装置A一段时间后,B中的现象是_____,当装置C中溶液由蓝色变为无色,由此推测所得无色溶液中的离子主要是H+、I- 和____;为了进一步实验证实了该过程中SO2已被氧化,该实验操作及现象是:_____。
(5)关闭K1,打开K2,用酒精灯加热装置A,观察到E中发生的现象是:有白色沉淀产生,白色沉淀的成分是_____,生成白色沉淀的原因可能是___(选填字母序号)。
a.SO2与BaCl2溶液反应生成了白色沉淀
b.BaCl2溶液与硫酸蒸气反应生成了白色沉淀
c.SO2溶于水生成的H2SO3被装置内的O2氧化生成H2SO4,再与BaCl2反应生成白色沉淀
(6)取A中产生的SO2气体通入足量双氧水中,然后加入足量BaCl2溶液,经过滤、洗涤、干燥得到4.66 g沉淀。据此推知SO2气体的体积为___mL(标准状况)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com