
【题目】学生研究性学习小组设计实验,用于制取SO2并探究SO2的某些性质。制取SO2反应的化学方程式为:Na2SO3+2H2SO4→Na2SO4+SO2↑+H2O,产生的气体通入如图所示装置:
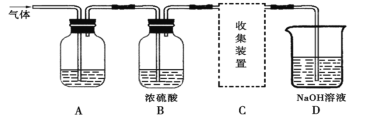
(实验探究)
(1)将12.6g的Na2SO3与足量的浓硫酸反应可制得SO2的体积为___________L(标准状况),该制取SO2的反应________(选填“是”或“不是”)氧化还原反应。
(2)若用A装置检验SO2具有漂白性,则A中的溶液是_________。
若用A装置检验SO2是一种酸性氧化物,则A中的溶液是_________。
(3)D装置中发生的反应是(写化学方程式):____________________________________。
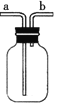
(实验讨论)
(4)对如图中的C处,甲、乙两同学都选用如图装置,但对连接方式持有不同意见。甲同学认为:SO2气体应从a处通入集气瓶中。乙同学认为:SO2气体应从b处通入集气瓶中。你认为________(填“甲”或“乙”)同学的看法是正确的。
(联系实际)
(5)SO2对环境的影响较大,为了减少SO2对空气的污染,请你从工业生产的角度提出一种有效可行的措施(用文字表述):________________________________________。
【答案】2.24 不是 品红溶液 石蕊试液 SO2+2NaOH=Na2SO3+H2O 甲 优先使用低硫燃料,对煤和石油进行脱硫;对燃烧后形成的烟气在排放之前除去硫的氧化物;开发其他清洁能源
【解析】
(1)由质量求出的Na2SO3物质的量,二氧化硫的物质的量与Na2SO3物质的量相等,带入n=![]() 求算体积,反应前后化合价发生变化的反应属于氧化还原反应;
求算体积,反应前后化合价发生变化的反应属于氧化还原反应;
(2)二氧化硫可使品红溶液褪色,表现了二氧化硫的漂白性;二氧化硫使石蕊试液变红,说明其溶于水显酸性;
(3)浓硫酸的作用是干燥二氧化硫气体,浓硫酸不能氧化二氧化硫气体;
(4)二氧化硫气体污染大气,为酸性气体,装置D氢氧化钠可吸收二氧化硫;二氧化硫气体密度比空气的大,应用向上排空气法收集;
(5)减少SO2对空气的污染可从产生源头、产生后吸收等方面采取措施.
(1)n(Na2SO3)= ![]() = 0.1 mol,根据化学方程式可知,二氧化硫的物质的量与Na2SO3物质的量相等,生成标准状况下的二氧化硫的体积V=0.1 mol×22.4 L/mol = 2.24 L;在Na2SO3+2H2SO4=Na2SO4+SO2↑+H2O中S的化合价没有发生变化,因此该反应不属于氧化还原反应,
= 0.1 mol,根据化学方程式可知,二氧化硫的物质的量与Na2SO3物质的量相等,生成标准状况下的二氧化硫的体积V=0.1 mol×22.4 L/mol = 2.24 L;在Na2SO3+2H2SO4=Na2SO4+SO2↑+H2O中S的化合价没有发生变化,因此该反应不属于氧化还原反应,
故答案为:2.24;不是;
(2)二氧化硫可使品红溶液褪色,表现了二氧化硫的漂白性,二氧化硫通入石蕊试液使其变红,说明二氧化硫是酸性氧化物,
故答案为:品红溶液褪色;石蕊试液;
(3)二氧化硫气体污染大气,二氧化硫能与氢氧化钠溶液反应而被吸收,因此装置D作为尾气吸收之用,其化学方程式为:SO2+2NaOH=Na2SO3+H2O,
故答案为:SO2+2NaOH=Na2SO3+H2O;
(4)二氧化硫气体密度比空气的大,应用向上排空气法收集,应该从a进入集气瓶,故甲同学正确,
故答案为:甲;
(5)从工业生产的角度来看,优先使用低硫燃料,对煤和石油进行脱硫;对燃烧后形成的烟气在排放之前除去硫的氧化物;开发其他清洁能源等都可以减少二氧化硫对环境的影响,故答案为优先使用低硫燃料,对煤和石油进行脱硫;对燃烧后形成的烟气在排放之前除去硫的氧化物;开发其他清洁能源。


 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案科目:高中化学 来源: 题型:
【题目】一定条件下A、B、C的如下图所示的转化关系,且△H=△H1+△H2。则A、C可能是( )

①Fe、FeCl3 ②C、CO2 ③AlCl3、NaAlO2 ④NaOH、NaHCO3 ⑤S、CuS ⑥Na2CO3、CO2
A.②③④⑥ B.②③④⑤⑥ C.①②③④⑥ D.①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学试剂在实验室中的保存方法正确的是
A.钠可放煤油中保存B.可用玻璃细口试剂瓶保存氢氟酸
C.用无色透明试剂瓶保存氯水D.用磨口玻璃塞的试剂瓶保存氢氧化钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用密度为1.18g/ml,质量分数为36.5%浓盐酸配制250ml0.1mol/L的盐酸溶液,填空并请回答下列问题:
(1)配制250ml0.1mol/L的盐酸溶液.应量取盐酸体积_________ml,应选用容量瓶的规格__________________ml。
(2)配制时,其正确的操作顺序是________。
A.用30ml水洗涤烧杯 2﹣3次,洗涤液均注入容量瓶,振荡
B.用量筒量准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30ml),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入250ml的容量瓶中
D.将容量瓶盖紧、振荡、摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1﹣2cm处
a.BCAFED b.BCFED c.BCAED
(3)操作B中,使用量筒量取液体时视线俯视会造成配制液体浓度__________(偏高、偏低或无影响)。操作E中加水超过刻度线该如何处理?____________
(4)若出现如下情况,对所配溶液浓度将有何影响(偏高、偏低或无影响)?
a.没有进行A操作____________;
b.加蒸馏水时不慎超过了刻度___________;
c.定容时俯视_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】5种固体物质A、B、C、D、E由下表中不同的阴阳离子组成,它们均易溶于水。

分别取它们的水溶液进行实验,结果如下:
①C,E溶液显碱性,A,B,D溶液呈酸性,0.1mol/L的E溶液pH<13;
②B溶液与E溶液混合后产生红褐色沉淀,同时产生大量气体;
③少量C溶液与D溶液混合后产生白色沉淀,过量C溶液与D溶液混合后无现象;
④将38.4 g Cu片投入装有足量D溶液的试管中,Cu不溶解,再滴加1.6 mol·L-1稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现。
(1)据此推断C、D的化学式为:C______________;D_______________。
(2)写出步骤②中发生反应的离子反应方程式____________________________。
(3)步骤④中若要将Cu片完全溶解,至少加入稀H2SO4的体积是____________mL。
(4)不能确定的溶液为B和______________(填字母编号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据框图分析,下列说法不正确的是
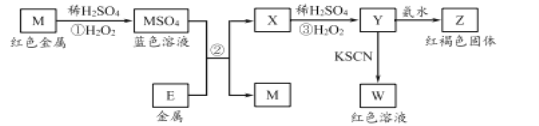
A. 我国是世界上最早使用反应②冶炼金属M的国家
B. M2+的氧化性比E2+的氧化性强
C. 在反应③中若不加稀硫酸,可能观察到红褐色沉淀
D. 在反应①中稀硫酸既表现出氧化性又表现出酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某位同学配制一定物质的量浓度的NaOH溶液时,造成所配溶液浓度偏低的原因是( )
A. 容量瓶用蒸馏水洗涤干净后没有干燥 B. 定容时仰视
C. 砝码上沾有杂质 D. 没冷却至室温就定容
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用![]() 高能原子轰击
高能原子轰击![]() 的靶子,使锌核与铅核熔合,生成一个112号元素的原子的同时向外释放出一个中子。下列说法错误的是
的靶子,使锌核与铅核熔合,生成一个112号元素的原子的同时向外释放出一个中子。下列说法错误的是
A. 112号元素的相对原子质量为277
B. 此变化不属于化学变化
C. 科学家合成的112号元素是金属元素
D. 112号元素位于第七周期第ⅡB族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增大。m、p、q、r、s是由这些元素组成的二元化合物,常温常压下r为液体,其余均为无色气体。m的摩尔质量为p的2倍,n是Y元素的单质,是绿色植物光合作用产生的无色气体,p物质能使湿润的红色石蕊试纸变蓝,q能使品红溶液褪色。上述物质的转化关系如图所示。下列说法正确的是( )

A. q与s均为酸性氧化物B. Z的含氧酸是一种强酸
C. X、Y分别与W形成10e-的微粒能反应生成一种气体D. 原子半径:W<Y<X
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com