
【题目】根据框图分析,下列说法不正确的是
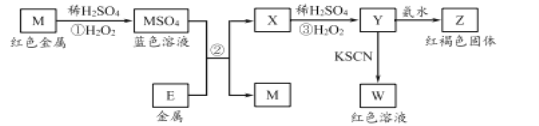
A. 我国是世界上最早使用反应②冶炼金属M的国家
B. M2+的氧化性比E2+的氧化性强
C. 在反应③中若不加稀硫酸,可能观察到红褐色沉淀
D. 在反应①中稀硫酸既表现出氧化性又表现出酸性
【答案】D
【解析】红色金属为Cu,反应①发生Cu+H2O2+H2SO4=CuSO4+2H2O,蓝色溶液为CuSO4溶液,Z为红褐色固体,即Z为Fe(OH)3,说明E为Fe,反应②发生Fe+CuSO4=FeSO4+Cu,反应③发生2Fe2++2H++H2O2=2Fe3++2H2O,A、反应②是湿法炼铜,我国是世界上最早使用湿法炼铜的国家,故A说法正确;B、反应②发生发生Fe+CuSO4=FeSO4+Cu,利用氧化剂的氧化性强于氧化产物的氧化性,即Cu2+的氧化性强于Fe2+,故B说法正确;C、生成Fe3+发生水解,生成氢氧化铁,因此可能观察到红褐色沉淀,故C说法正确;D、发生的反应方程式为Cu+H2O2+H2SO4=CuSO4+2H2O,H2SO4中元素的化合价没有发生变化,H2SO4表现酸性,H2O2表现氧化性,故D说法错误。


科目:高中化学 来源: 题型:
【题目】下表标出的是元素周期表的一部分元素,回答下列问题:
1 | ||||||||||||||||||
2 | A | B | C | |||||||||||||||
3 | D | E | F | G | H | I | J | K | ||||||||||
4 | M | |||||||||||||||||
(1)在上表用字母标出的12种元素中,化学性质最不活泼的是____(用元素符号表示,下同),金属性最强的是___,除稀有气体外第三周期中原子半径最小的是____,属于过渡元素的是___(该空格用表中的字母表示)。
(2)J的氢化物的电子式为____,最高价氧化物对应的水化物的化学式为___。
(3)为比较元素A和G的非金属性强弱,用下图所示的装置进行实验(夹持仪器已略去,装置气密性良好)。溶液B应该选用_____溶液,作用是_____,能说明A和G非金属性强弱的化学方程式是______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述错误的是
A.根据盐酸能导电可判断:氯化氢为电解质
B.根据溶液显碱性可判断:纯碱属于碱类
C.根据是否有电子转移可判断:漂白粉在空气中久置失效,其中存在氧化还原反应
D.根据发挥漂白作用的物质性质推断:氯水和活性炭的漂白原理不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 化学反应除了生成新物质外,还伴随着能量的变化
B. 物质燃烧和中和反应均放出热量
C. 分解反应肯定是吸热反应
D. 化学反应是吸热还是放热决定于生成物具有的总能量和反应物具有的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】学生研究性学习小组设计实验,用于制取SO2并探究SO2的某些性质。制取SO2反应的化学方程式为:Na2SO3+2H2SO4→Na2SO4+SO2↑+H2O,产生的气体通入如图所示装置:
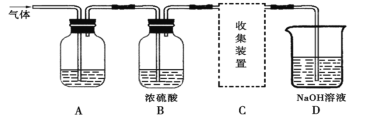
(实验探究)
(1)将12.6g的Na2SO3与足量的浓硫酸反应可制得SO2的体积为___________L(标准状况),该制取SO2的反应________(选填“是”或“不是”)氧化还原反应。
(2)若用A装置检验SO2具有漂白性,则A中的溶液是_________。
若用A装置检验SO2是一种酸性氧化物,则A中的溶液是_________。
(3)D装置中发生的反应是(写化学方程式):____________________________________。
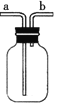
(实验讨论)
(4)对如图中的C处,甲、乙两同学都选用如图装置,但对连接方式持有不同意见。甲同学认为:SO2气体应从a处通入集气瓶中。乙同学认为:SO2气体应从b处通入集气瓶中。你认为________(填“甲”或“乙”)同学的看法是正确的。
(联系实际)
(5)SO2对环境的影响较大,为了减少SO2对空气的污染,请你从工业生产的角度提出一种有效可行的措施(用文字表述):________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醇与氢卤酸反应是制备卤代烃的重要方法。实验室制备溴乙烷和1-溴丁烷的反应如下:
NaBr+H2SO4=HBr+NaHSO4①
R—OH+HBr![]() R—Br+H2O②
R—Br+H2O②
可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,Br-被浓硫酸氧化为Br2等。有关数据列表如下:
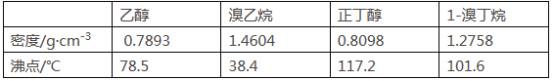
请回答下列问题:
(1)溴乙烷和1溴丁烷的制备实验中,下列仪器最不可能用到的是________(填字母)。
a.圆底烧瓶 b.量筒 c.锥形瓶 d.布氏漏斗
(2)溴代烃的水溶性________(填“大于”、“等于”或“小于”)相应的醇,其原因是_________。
(3)将1溴丁烷粗产品置于分液漏斗中加水,振荡后静置,产物在________(填“上层”“下层”或“不分层”)。
(4)制备操作中,加入的浓硫酸必须进行稀释,其目的是________(填字母)。
a.减少副产物烯和醚的生成 b.减少Br2的生成
c.减少HBr的挥发 d.水是反应的催化剂
(5)欲除去溴乙烷中的少量杂质Br2,下列物质中最适合的是________(填字母)。
a.NaI b.NaOH c.NaHSO3d.KCl
(6)在制备溴乙烷时,采用边反应边蒸出产物的方法,其有利于_______;但在制备1溴丁烷时却不能边反应边蒸出产物,其原因是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图,下列叙述正确的是( )

A. 每生成2分子AB吸收b kJ热量
B. 该反应中反应物的总能量高于生成物的总能量
C. 该反应热ΔH=+(a-b) kJ·mol-1
D. 断裂1 mol A—A和1 mol B—B键,放出a kJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量的Fe、FeO、Fe2O3的混合物中加入100mL浓度为1.0mol·L-1的盐酸,恰好使混合物完全溶解,有气体放出,所得溶液中加入KSCN溶液后无红色出现。若用足量的CO在高温下还原相同质量此混合物,能得到铁的质量是( )
A. 11.2g B. 5.6g
C. 2.8g D. 1.4g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com