
【题目】下列叙述错误的是
A.根据盐酸能导电可判断:氯化氢为电解质
B.根据溶液显碱性可判断:纯碱属于碱类
C.根据是否有电子转移可判断:漂白粉在空气中久置失效,其中存在氧化还原反应
D.根据发挥漂白作用的物质性质推断:氯水和活性炭的漂白原理不同
科目:高中化学 来源: 题型:
【题目】浓硫酸与金属的反应是我们一直探讨和研究的重要课题之一。
Ⅰ.铜与浓硫酸反应的过程中,发现有黑色物质出现,且黑色物质为Cu2S。产生Cu2S的反应为aCu+bH2SO4![]() cCu2S+dCuSO4+eH2O。则a:b=______.
cCu2S+dCuSO4+eH2O。则a:b=______.
Ⅱ.为研究铁质材料与热浓硫酸的反应,某学习小组用碳素钢(即铁和碳的合金)进行了以下探究活动:
(探究一)(1)常温下,工业上用铁质容器盛放冷的浓硫酸,其原因是________;
(2)铁与浓硫酸在加热时的化学方程式为:______________;
(3)称取碳素钢6.0g放入15.0ml浓硫酸中,加热,充分反应后得到溶液X并收集到混合气体Y。
①甲同学认为X中除Fe3+之外还可能含有Fe2+。若要确认其中的Fe2+,应选用____________;
a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c.浓氨水 d.酸性KMnO4溶液
②乙同学取560mL(标准状况)气体Y通入足量溴水中,发生反应后加入足量BaCl2溶液,经适当操作后得干燥固体4.66g。由此推知气体Y中SO2的体积分数为_______;
(探究二)根据上述实验中SO2体积分数的分析,丙同学认为气体Y中还可能含有Q1和Q2两种气体,其中Q1气体在标准状况下密度为0.0893g/L。为此设计了下列探究实验装置(图中夹持仪器省略,假设有关气体完全反应)。
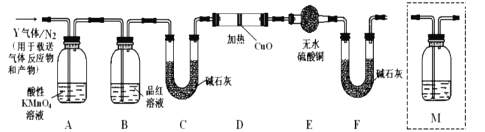
(4)装置B中试剂的作用是__________;
(5)分析Y气体中的![]() 气体是如何生成的___________(用化学方程式表示):
气体是如何生成的___________(用化学方程式表示):
(6)为确认![]() 的存在,需在装置中添加洗气瓶M于___________;
的存在,需在装置中添加洗气瓶M于___________;
a.A之前 b.A-B间 c.B-C间 d.C-D间
(7)如果气体Y中含有![]() ,预计实验现象应是_________________。
,预计实验现象应是_________________。
Ⅲ.将一定质量的Zn与100mL一定浓度的H2SO4充分反应:
(1)若反应前c(H2SO4)=12.0mol/L,反应后称量剩余锌发现质量减少了65.0g。将反应后的溶液稀释至1L,此时溶液中c(SO42-)=______mo/L,产生SO2体积(标准状况下)V(SO2)=______L;
(2)将(1)中产生的气体缓缓通入100mL a mo/L NaOH溶液中,SO2和NaOH都完全消耗,则a的取值范围为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化过程中ΔH<0的是( )
A.高温下木炭还原二氧化碳B.工业制水煤气的反应
C.Ba(OH)28H2O与NH4Cl的反应D.液化石油气的燃烧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学试剂在实验室中的保存方法正确的是
A.钠可放煤油中保存B.可用玻璃细口试剂瓶保存氢氟酸
C.用无色透明试剂瓶保存氯水D.用磨口玻璃塞的试剂瓶保存氢氧化钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知酸性高锰酸钾溶液可以将FeSO4氧化,方程式为:2KMnO4+10FeSO4+8H2SO4=K2SO4+2MnSO4+5Fe2(SO4)3+8H2O,现将一定量的硫酸酸化的高锰酸钾溶液与硫酸亚铁溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中铁离子的物质的量随加入的KI的物质的量的变化关系如图所示.则下列有关说法错误的是( )
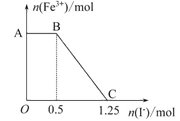
A. 图中AB段主要是高锰酸钾和碘化钾溶液反应
B. 图中BC段发生的反应为2Fe3++2I-=2Fe2++I2
C. 根据OC段的数据可知开始加入的硫酸亚铁的物质的量为1.25mol
D. 根据OC段的数据可知开始加入的高锰酸钾的物质的量为0.25mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用密度为1.18g/ml,质量分数为36.5%浓盐酸配制250ml0.1mol/L的盐酸溶液,填空并请回答下列问题:
(1)配制250ml0.1mol/L的盐酸溶液.应量取盐酸体积_________ml,应选用容量瓶的规格__________________ml。
(2)配制时,其正确的操作顺序是________。
A.用30ml水洗涤烧杯 2﹣3次,洗涤液均注入容量瓶,振荡
B.用量筒量准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30ml),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入250ml的容量瓶中
D.将容量瓶盖紧、振荡、摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1﹣2cm处
a.BCAFED b.BCFED c.BCAED
(3)操作B中,使用量筒量取液体时视线俯视会造成配制液体浓度__________(偏高、偏低或无影响)。操作E中加水超过刻度线该如何处理?____________
(4)若出现如下情况,对所配溶液浓度将有何影响(偏高、偏低或无影响)?
a.没有进行A操作____________;
b.加蒸馏水时不慎超过了刻度___________;
c.定容时俯视_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据框图分析,下列说法不正确的是
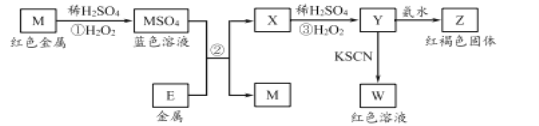
A. 我国是世界上最早使用反应②冶炼金属M的国家
B. M2+的氧化性比E2+的氧化性强
C. 在反应③中若不加稀硫酸,可能观察到红褐色沉淀
D. 在反应①中稀硫酸既表现出氧化性又表现出酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于各图像的解释或结论正确的是
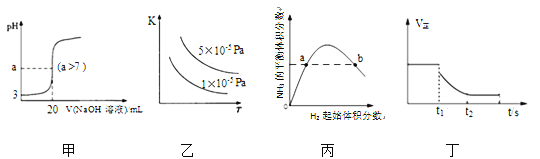
A. 图甲表示常温下向20mL pH=3的醋酸溶液中滴加pH=11的NaOH溶液,溶液的pH随NaOH溶液体积的变化关系
B. 图乙表示2SO2(g)+O2(g)![]() 2SO3(g) △H<0的平衡常数K与温度和压强的关系
2SO3(g) △H<0的平衡常数K与温度和压强的关系
C. 图丙表示一定条件下的合成氨反应,N2的起始量恒定时,NH3的平衡体积分数随H2起始体积分数的变化,图中a点N2的转化率等于b点
D. 图丁表示反应 2SO2+O2 ![]() 2SO3,t1 时刻降低温度符合图示变化
2SO3,t1 时刻降低温度符合图示变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com