
【题目】卤素单质可以参与很多化学反应, 如:NF3气体可由NH3和F2在Cu催化剂存在下反应直接得到;反应①:2NH3+3F2![]() NF3+ 3NH4F,Ta(钽)是一种过渡元素,利用“化学蒸气转移法”可以制备TaS2晶体;反应②:TaI4(g)+S2(g)
NF3+ 3NH4F,Ta(钽)是一种过渡元素,利用“化学蒸气转移法”可以制备TaS2晶体;反应②:TaI4(g)+S2(g)![]() TaS2(s)+2I2(g)+QkJ,Q>0
TaS2(s)+2I2(g)+QkJ,Q>0
(1)反应①中:非金属性最强的元素原子核外有____种不同运动状态的电子;该反应中的某元素的单质可作粮食保护气,则该元素最外层的电子有___种自旋方向。
(2)反应①中:物质所属的晶体类型有____;并写出所有原子符合8电子稳定结构的化合物的电子式____。
(3)反应②中:平衡常数表达式:K=___,若反应达到平衡后,保持其他条件不变,降低温度,重新达到平衡时____。
a.平衡常数K增大 b. S2的浓度减小 c. I2的质量减小 d. V(TaI4)逆 增大
(4)反应②在一定温度下进行,若反应容器的容积为2L,3min后达到平衡,测得蒸气的质量减少了2.45g,则I2的平均反应速率为___。
(5)某同学对反应②又进行研究,他查阅资料,发现硫单质有多种同素异形体,可表示Sx(x为偶数),且在一定条件下可以相互转化,他认为仅增大压强对平衡是有影响的,则TaI4的平衡转化率会____(填增大或减小),其原因是___。
【答案】9 2 分子晶体、金属晶体、离子晶体 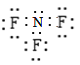 [I2]2/[TaI4][S2] ab 0.00333mol/(Lmin)或1/300 mol/(Lmin) 平衡转化率会减小 原因是在S2可以转化为S4或S6或S8+,2TaI4(g)+S4(g)
[I2]2/[TaI4][S2] ab 0.00333mol/(Lmin)或1/300 mol/(Lmin) 平衡转化率会减小 原因是在S2可以转化为S4或S6或S8+,2TaI4(g)+S4(g)![]() 2TaS2(s)+4I2(g)加压使平衡向逆反应方向进行
2TaS2(s)+4I2(g)加压使平衡向逆反应方向进行
【解析】
(1)反应①中:非金属性最强的元素是F,原子中没有运动状态相同的电子,核外有几个电子就有几种不同运动状态的电子;氮气可作粮食保护气,最外层有5个电子,电子的自旋方向有2种;
(2)根据共价物质的组成分析晶体的类型;对于ABn的共价化合物,各元素满足|化合价|+元素原子的最外层电子数=8,原子都满足最外层8电子结构;,然后书写电子式;
(3)平衡常数为产物浓度系数次幂的乘积与反应物浓度系数次幂的乘积的比值;该反应为放热反应,降低温度,平衡正向移动;
(4)反应容器的容积为2L,3min后达到平衡,测得蒸气的质量减少了2.45g,依据化学方程式的气体质量变化计算反应I2物质的量,依据化学反应速率概念计算;
(5)根据S2会转变成S4、S6、S8,反应物气体的物质的量偏小。
(1)反应①中:非金属性最强的元素是F,F原子中有9个电子,就有9种不同运动状态的电子;氮气可作粮食保护气,最外层有5个电子,电子的自旋方向有2种;
(2)NH3、F2、NF3属于分子晶体,NH4F属于离子晶体,Cu属于金属晶体;NF3中N元素化合价为+3,N原子最外层电子数为5,所以3+5=8,分子中N原子满足8电子结构;F元素化合价为-1,F原子最外层电子数为7,所以|-1|+7=8,分子中F原子满足8电子结构,电子是为: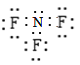 ;
;
(3)反应TaI4(g)+S2(g)![]() TaS2(s)+2I2(g)体系中,平衡常数为产物浓度系数次幂的乘积与反应物浓度系数次幂的乘积的比值,K=
TaS2(s)+2I2(g)体系中,平衡常数为产物浓度系数次幂的乘积与反应物浓度系数次幂的乘积的比值,K=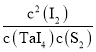 ;该反应为放热反应,降低温度,平衡正向移动;
;该反应为放热反应,降低温度,平衡正向移动;
a.降低温度,平衡正向移动,平衡常数K增大,故a正确;
b.平衡正向移动,S2的浓度减小,故b正确;
c.平衡正向移动,I2的质量增大,故c错误;
d.温度降低,V(TaI4)逆减小,故d错误;
故答案为:ab;
(4)若反应容器的容积为2L,3min后达到平衡,测得蒸气的质量减少了2.45g,则
TaI4(g)+S2(g)![]() TaS2(s)+2I2(g) △m
TaS2(s)+2I2(g) △m
2mol 245g
0.02mol 2.45g
生成的I2为0.02mol,则I2的平均反应速率= =0.00333mol/(Lmin);
=0.00333mol/(Lmin);
(5)S2会转变成S4或S6或S8,反应物气体的物质的量偏小,所以增大压强,平衡逆向移动,TaI4的平衡转化率减小。


科目:高中化学 来源: 题型:
【题目】(I)有下列几组物质或原子:①612C和614C②H③Na2O2④P⑤N⑥H2⑦O2和O3⑧烧碱、纯碱及苛性钠。选择适当的序号回答有关问题:
(1)属于第二周期ⅤA族的元素是_____________;
(2)含有非极性键的离子化合物是_____________;
(3)互为同位素的是_____________;
(4)原子半径最小的原子形成的分子是_____________;
(5)属于同素异形体的是_____________。
(II)用合理的化学用语回答下列问题
(1)甲烷分子的电子式:_____________;
(2)乙烯分子的结构简式:_____________;
(3)甲烷和氯气光照生成一氯甲烷方程式:_____________;
(4)苯和液溴在铁屑催化下反应生成溴苯方程式:_____________;
(5)乙醇和金属钠反应生成乙醇钠方程式:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W原子序数依次增大。X氢化物的水溶性显碱性;Y在元素周期表中所处的周期序数与族序数相等;Z单质是将太阳能转化为电能的常用材料,也是一种半导体材料;W是重要的“成盐元素”,主要以钠盐的形式存在于海水中。请回答:
(1)Y在元素周期表中的位置是________。
(2)Y的最高氧化物相应水化物具有______(填“酸性”、“碱性”、“两性”)。并写出其电离方程式______。
(3)X氢化物的水溶液与W氢化物的水溶液混合后恰好反应时,溶液呈__性(填“酸”、“碱”或“中”),用离子方程式表示其原因是__。
(4)Z和W比较,非金属性较弱的是_______(填元素符号)。下列可以验证这一结论的是_______(填序号)。
a.元素在地壳中的含量
b.最高价氧化物对应水化物的酸性
c.氢化物的水溶性
d.Z与W以共价键形成化合物时,Z或W显示的化合价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据有机化合物的命名原则,下列命名正确的是
A.![]() 3-甲基-1,3-丁二烯
3-甲基-1,3-丁二烯
B.![]() 2-羟基丁烷
2-羟基丁烷
C.CH3CH(C2H5)CH2CH2CH3 2-乙基戊烷
D.(CH3)3CCl 2-甲基-2-氯丙烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置进行下列实验,能得到相应实验结论的是( )

选项 | ① | ② | ③ | 实验结论 |
A | 浓硫酸 | Na2SO3 | 酸性KMnO4溶液褪色 | SO2有漂白性 |
B | 浓硫酸 | Cu | 品红溶液 | SO2具有漂白性 |
C | 稀盐酸 | 碳酸钠 | 氯化钙溶液 | CO2与CaCl2不反应 |
D | 浓硫酸 | 蔗糖 | 溴水褪色 | 浓硫酸具有脱水性、吸水性 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以乙烯与甲苯为主要原料,按下列路线合成一种香料W:
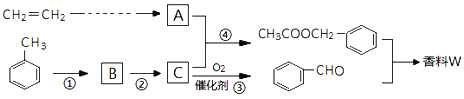
(1)实验室制备乙烯的反应试剂与具体反应条件为____。
(2)上述①~④反应中,属于取代反应的是___。
(3)检验反应③是否发生的方法是____。
(4)写出两种满足下列条件的![]() 同分异构体的结构简式。____、____。
同分异构体的结构简式。____、____。
a.能发生银镜反应 b.苯环上的一溴代物有两种
(5)设计一条由乙烯制备A的合成路线。(无机试剂可以任选)____。
(合成路线常用的表示方式为: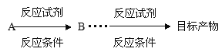 )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯催化氧化成乙醛可设计成如下图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为:2CH2=CH2+O2→2CH3CHO。下列有关说法正确的是
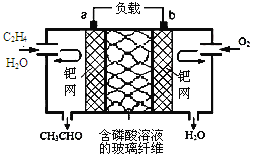
A.a电极发生还原反应
B.放电时,每转移2mol电子,理论上需要消耗28g乙烯
C.b极反应式为:O2+4e-+2H2O=4OH-
D.电子移动方向:电极a→磷酸溶液→电极b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)纯碱是一种重要的化工原料。目前制碱工业主要有“氨碱法”和“联合制碱法”两种工艺。
①“氨碱法”产生大量CaCl2废弃物,写出该工艺中产生CaCl2的化学方程式:___;
②CO2是制碱工业的重要原料,“联合制碱法”与“氨碱法”中CO2的来源有何不同?___;
(2)某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计的方案实验.①一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如图所示(图中夹持、固定用的仪器未画出)试回答下列有关问题:
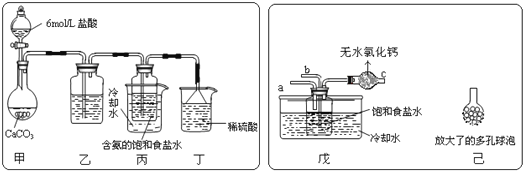
(Ⅰ)乙装置中的试剂是___;其作用是____;
(Ⅱ)丁装置中稀硫酸的作用是___;
(Ⅲ)实验结束后,分离出NaHCO3晶体的操作是___(填分离操作的名称).该操作所需是玻璃仪器有____。
②另一位同学用图中戊装置(其它装置未画出)进行实验。
(Ⅰ)实验时,须先从__(“a”或“b”)管通入___气体,说明原因___。
(Ⅱ)有同学建议在戊装置的b管下端连接己装置,理由是___。
(III)碳酸氢钠受热所得固体12.28g与足量石灰水充分反应,所得沉淀经洗涤、干燥质量为12.00g,则所得固体中碳酸钠的质量分数为:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列中心原子的杂化轨道类型和分子立体构型不正确的是( )
A. PCl3中P原子采用sp3杂化,为三角锥形
B. BCl3中B原子采用sp2杂化,为平面三角形
C. CS2中C原子采用sp杂化,为直线形
D. H2S中S原子采用sp杂化,为直线形
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com