
【题目】(I)有下列几组物质或原子:①612C和614C②H③Na2O2④P⑤N⑥H2⑦O2和O3⑧烧碱、纯碱及苛性钠。选择适当的序号回答有关问题:
(1)属于第二周期ⅤA族的元素是_____________;
(2)含有非极性键的离子化合物是_____________;
(3)互为同位素的是_____________;
(4)原子半径最小的原子形成的分子是_____________;
(5)属于同素异形体的是_____________。
(II)用合理的化学用语回答下列问题
(1)甲烷分子的电子式:_____________;
(2)乙烯分子的结构简式:_____________;
(3)甲烷和氯气光照生成一氯甲烷方程式:_____________;
(4)苯和液溴在铁屑催化下反应生成溴苯方程式:_____________;
(5)乙醇和金属钠反应生成乙醇钠方程式:_____________。
【答案】⑤ ③ ① ⑥ ⑦ 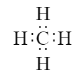 CH2=CH2 CH4+Cl2
CH2=CH2 CH4+Cl2![]() CH3Cl+HCl C6H6+Br2
CH3Cl+HCl C6H6+Br2![]() C6H5Br+HBr 2C2H5OH+2Na→2C2H5ONa+H2↑
C6H5Br+HBr 2C2H5OH+2Na→2C2H5ONa+H2↑
【解析】
(I)H、P、N分别位于第一周期ⅠA族、第三周期ⅤA族、第二周期ⅤA族;612C和614C质子数都为6,中子数不同,是碳元素的不同原子,互为同位素;Na2O2是含有离子键和共价键的离子化合物,两个氧原子之间形成的是非极性的共价键,过氧根离子与Na+之间形成的是离子键;O2和O3都是由氧元素组成的不同单质,互为同素异形体;烧碱和苛性钠指的都是NaOH,纯碱是Na2CO3。
(1)由分析可知,属于第二周期ⅤA族的元素是N,即⑤;
(2)含有非极性键的离子化合物是Na2O2,即③;
(3)互为同位素的是612C和614C,即①;
(4)原子半径最小的原子是H原子,其形成的分子是H2,即⑥;
(5)属于同素异形体的是O2和O3,即⑦;
(II)(1)甲烷分子的电子式为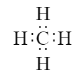 ;
;
(2)乙烯分子的结构简式为CH2=CH2;
(3)甲烷和氯气光照生成一氯甲烷的化学方程式为:CH4+Cl2![]() CH3Cl+HCl;
CH3Cl+HCl;
(4)苯和液溴在铁屑催化下反应生成溴苯的化学方程式为:C6H6+Br2![]() C6H5Br+HBr;
C6H5Br+HBr;
(5)乙醇和金属钠反应生成乙醇钠的化学方程式为:2C2H5OH+2Na→2C2H5ONa+H2↑。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】I.CO、CO2的应用和治理是当今社会的热点问题。
CO工业上可用于高炉炼铁,发生如下反应: 1/3Fe2O3(s) + CO(g)![]() 2/3Fe(s) + CO2(g),已知该反应在不同温度下的平衡常数如下表:
2/3Fe(s) + CO2(g),已知该反应在不同温度下的平衡常数如下表:
温度/℃ | 1000 | 1150 | 1300 |
平衡常数 | 4.0 | 3.7 | 3.5 |
(1)该反应的正反应为_____反应(填“放热”或“吸热”),欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是____(选填序号)
a.及时吸收或移出CO2 b.增大反应体系的压强
c.用更高效的催化剂 d.粉碎矿石,增大接触面积
(2)一定条件下,在容积一定的容器中,铁和CO2发生反应:Fe(s)+CO2(g)![]() FeO(s)+CO(g)-Q,该反应的平衡常数表达式K=_____________。下列措施中能使平衡时
FeO(s)+CO(g)-Q,该反应的平衡常数表达式K=_____________。下列措施中能使平衡时![]() 增大的是______(选填编号)。
增大的是______(选填编号)。
a.升高温度 b.增大压强
c.充入一定量CO d.再加入一些铁粉
II.合成尿素的反应为:2NH3(g)+CO2(g) ![]() CO(NH2)2(s)+H2O(g)+Q(Q>0)。
CO(NH2)2(s)+H2O(g)+Q(Q>0)。
一定条件下,在10 L的恒容密闭容器中,充入2 mol NH3和1 mol CO2,反应经5 min后达到平衡,测得容器中CO2的浓度为0.05molL-1 。
完成下列填空:
(1)平均反应速率υ(NH3)=____________。
(2)下列描述中能说明上述反应已达平衡的是_________。(填序号)
a.2υ正(NH3)=υ逆(H2O) b.气体的平均相对分子质量不随时间而变化
c.NH3和CO2的比例保持不变 d.气体的压强不再发生变化
(3)为提高尿素的产率,工业上用该反应生产尿素时,合适的反应条件是_______。(填序号)
a.200℃ b.800℃ c.101 kPa d.24000 kPa
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaCl溶液中混有Na2SO4、CaCl2溶液和淀粉胶体,选择适当的试剂和方法从中提纯出NaCl晶体。相应的实验过程如图:
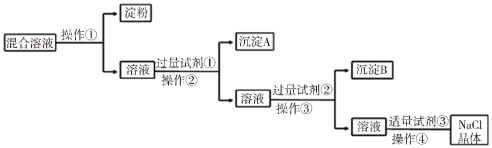
(1)操作①是利用半透膜进行分离提纯。
操作①的实验结果:淀粉___(填“能”或“不能”)透过半透膜;SO42-___(填“能”或“不能”)透过半透膜。
(2)写出实验过程中所用试剂(写化学式):
试剂①___;试剂③___。
(3)判断试剂①已过量的方法是:___。
(4)用离子方程式表示加入试剂②的作用:Ba2++CO32-=BaCO3↓、___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据元素周期表中完整周期元素的性质,完成下列空格。
(1)在第三周期中,第一电离能最小的元素符号是________,其原子的结构示意图为__________,第一电离能最大的元素符号是________,其价电子排布式为___________________________。
(2)在元素周期表中,电负性最大的元素名称是________,其价电子排布图为______________
(3)第四周期元素中未成对电子数最多的元素符号是________,其原子的简化电子排布式为__________,有_____个未成对电子,有_____个能级,能量最高的能级符号为_______。
(4)某元素的基态原子价电子排布式为3d104s1 ,该元素符号是_________,原子中所有电子占有________个轨道,核外共有________个不同运动状态的电子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是可逆反应A+2B![]() 2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况。由此可推断下列结论错误的是( )
2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况。由此可推断下列结论错误的是( )
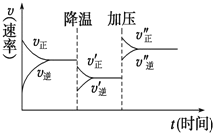
A.正反应是放热反应B.A、B一定都是气体
C.D一定不是气体D.C可能是气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为按原子序数由小到大排列的四种短周期的元素。其申Y、W位于同一主族,Z、W位于同一周期,Y的最外层电子数是K层电子数的3倍,Z是同一周期中金属性最强的元素,X的最外层电子数与Z相同,但X为非金属元素。请回答下列问题:
(1)Y、Z的元素符号分别是_____________、_____________。
(2)Z2W的电子式是_____________。
(3)Z2Y2与X2Y反应的化学方程式是:_____________
(4)Z2WY3与X2WY4反应的离子方程式是:_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的数值,下列说法正确的是( )
A. 28g乙烯、丙烯的混合气体中所含原子数为6NA
B. 28g乙烯所含共用电子对数目为4NA
C. 标准状况下,11.2 L氯仿(CHCl3)所含分子数为0.5 NA
D. 78g苯中含有C—C键数目为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. ![]() 分子中的所有原子有可能共平面
分子中的所有原子有可能共平面
B. ![]() 中有8个碳原子可能在同一条直线上
中有8个碳原子可能在同一条直线上
C. 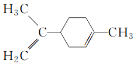 所有碳原子一定在同一平面上
所有碳原子一定在同一平面上
D. ![]() 至少有16个原子共平面
至少有16个原子共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤素单质可以参与很多化学反应, 如:NF3气体可由NH3和F2在Cu催化剂存在下反应直接得到;反应①:2NH3+3F2![]() NF3+ 3NH4F,Ta(钽)是一种过渡元素,利用“化学蒸气转移法”可以制备TaS2晶体;反应②:TaI4(g)+S2(g)
NF3+ 3NH4F,Ta(钽)是一种过渡元素,利用“化学蒸气转移法”可以制备TaS2晶体;反应②:TaI4(g)+S2(g)![]() TaS2(s)+2I2(g)+QkJ,Q>0
TaS2(s)+2I2(g)+QkJ,Q>0
(1)反应①中:非金属性最强的元素原子核外有____种不同运动状态的电子;该反应中的某元素的单质可作粮食保护气,则该元素最外层的电子有___种自旋方向。
(2)反应①中:物质所属的晶体类型有____;并写出所有原子符合8电子稳定结构的化合物的电子式____。
(3)反应②中:平衡常数表达式:K=___,若反应达到平衡后,保持其他条件不变,降低温度,重新达到平衡时____。
a.平衡常数K增大 b. S2的浓度减小 c. I2的质量减小 d. V(TaI4)逆 增大
(4)反应②在一定温度下进行,若反应容器的容积为2L,3min后达到平衡,测得蒸气的质量减少了2.45g,则I2的平均反应速率为___。
(5)某同学对反应②又进行研究,他查阅资料,发现硫单质有多种同素异形体,可表示Sx(x为偶数),且在一定条件下可以相互转化,他认为仅增大压强对平衡是有影响的,则TaI4的平衡转化率会____(填增大或减小),其原因是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com