
【题目】下列各项中,对所描述内容的相关分析不正确的是
选项 | 描述 | 分析 |
A | “青蒿一握,以水二升渍,绞取计” | 其中涉及到了萃取过程 |
B | 炼丹家制硫酸时用“炼石胆(胆矾)取其精华” | 其中利用了分解反应 |
C | 古代染坊常用某种碱剂来精炼丝绸 | 碱剂不可能为烧碱 |
D | “古剑‘沈卢’,以剂钢为刃” | 剂钢的成分为纯铁 |
A. A B. B C. C D. D
科目:高中化学 来源: 题型:
【题目】常温下,将20.0g质量分数为14.0%的KNO3溶液跟30.0g质量分数为24.0%的KNO3溶液混合,得到的密度为1.15g·cm-3的混合溶液。计算:
(1)混合后溶液的质量分数___________。
(2)混合后溶液的物质的量浓度_____________。
(3)在1000g水中需溶解_____________摩尔KNO3才能使其浓度恰好与上述混合后溶液的浓度相等?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列有关说法错误的是( )
A. 硅胶可作袋装食品的干燥剂
B. 点燃爆竹后,硫燃烧生成SO2
C. 加热能杀死流感病毒是因为蛋白质受热变性
D. 用聚乙烯塑料代替聚乳酸塑料可减少白色污染
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe、A1、Cu是生活中常用的金属。
(1)基态Cu原子核外电子排布式为_____________,基态Fe2+核外有_________个未成对电子。
(2)①re、Al、Cu三种元素第一电离能由高到低的顺序为___________________。
②Mn和Fe的部分电离能数据如下表:
元素 | Mn | Fe | |
电离能/kJ mol-1 | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 |
根据上表数据,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,其原因是_____________。
(3)铁可形成多种配合物,如[Fe(CN)6]4-、Fe(CO)5等,lmol Fe(CN)43-中含有σ键的数目为________;Fe(CO)5熔点为-20.5℃,沸点为103℃:易溶于CCl4,据此可以判断Fe(CO)3晶体属于________ (填晶体类型)。
(4)下列变化过程中,破坏的力的作用类型相同的是_____________;(填字母代号)。
A.铝气化 B.A1C13溶于水 C.加热使铜熔化 D.熔融NaC1
(5)Fe能与N形成一种磁性材料,其晶胞结构如图所示:

①该磁性材料的化学式为__________________;
②Fe原子的坐标参数为(![]() ,
, ![]() ,0)、(
,0)、(![]() ,0,
,0, ![]() )、________、(0,0,0),N原子的坐标参数为_______。
)、________、(0,0,0),N原子的坐标参数为_______。
③已知该晶体的晶胞参数α pm,列出其密度表达式为_________g cm-3(用含α的式子表示,只列式子,不作计算。)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
族 周期 | IA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
⑩ |
(1)⑧、⑩的最高价含氧酸的酸性由强到弱的顺序是__________________。③的最高价氧化物为__________;⑨的最高价含氧酸是__________(均填化学式)
(2)④、⑤、⑥的形成的简单离子半径的大小顺序___________。(用离子符号表示)⑤与水反应的离子方程式___________。
(3)①、④、⑤元素可形成既含离子键又含共价键的化合物,写出它的电子式:__________。
(4)在一定条件下,S与H2反应有一定限度(可理解为反应进行的程度),请判断在相同条件下Se与H2反应的限度_______(选填“更大”“更小”或“相同”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如图所示。

①在图示的转化中,化合价不变的元素是_________________。
②反应中当有1mol H2S转化为硫单质时,保持溶液中Fe3+的物质的量不变,需消耗O2的物质的量为_________________。
(2)已知硫有多种同素异形体,如S2 、S4、 S6 、S8等。H2S在高温下分解生成硫蒸气和H2。若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如图所示,H2S在高温下分解反应的化学方程式为_______________________。

(3)H3AsO3和H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如题20图- 1和题20图- 2所示。

(3)溶液的pH对吸附剂X表面所带电荷有影响。pH =7. 1时, 吸附剂X表面不带电荷; pH > 7.1时带负电荷,pH越高,表面所带负电荷越多;pH<7.1时带正电荷,pH越低,表面所带正电荷越多。pH不同时吸附剂X对三价砷和五价砷的平衡吸附量(吸附达平衡时单位质量吸附剂X吸附砷的质量)如题20图-3所示。

①在pH7~9之间,吸附剂X对五价砷的平衡吸附量随pH升高而迅速下降,其原因是____________。
②在pH4~7之间,吸附剂X对水中三价砷的去除能力远比五价砷的弱,这是因为___________。 提高吸附剂X对三价砷去除效果可采取的措施是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列反应事实写出相应的化学方程式。
(1)双氧水在二氧化锰的催化作用下生成水和氧气:____________。
(2)在尘埃的作用下,二氧化硫和氧气反应生成三氧化硫(SO3):___________。
(3)Cu和AgNO3溶液反应,生成Cu(NO3)2溶液和Ag:_____________。
(4)少量CuSO4溶液滴入NaOH稀溶液中生成Cu(OH)2沉淀和Na2SO4溶液:____________。
(5)一氧化碳和四氧化三铁(Fe3O4)在高温下反应,生成铁和二氧化碳:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】荧光棒的发光原理是利用过氧化氢氧化某草酸二酯产生能量传递给荧光物质发出荧光。该草酸二酯的结构简式如下图所示。下列有关该草酸二酯的说法不正确的是
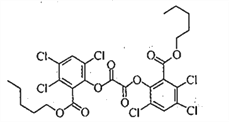
A. 分子中含有一种含氧官能团
B. 苯环上的一溴代物只有一种
C. 可以发生取代反应和加成反应
D. lmol草酸二酯与NaOH溶液反应最多消耗4mol NaOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com