
����Ŀ���̷���һ����Ҫ�Ļ���ԭ�ϣ�
��1��������1���̷����壨FeSO47H2O�����ڱ��治�÷��ã����ױ������е��������������ʣ�Ϊ̽���̷���Ʒ�ı��������ij��ѧ��ȤС���ͬѧ���������ʵ�鷽����ʵ������ȡ�����̷���Ʒ��������ˮ���ձ��������Һ��
�ٷ���1��ȡ������Һ�����뼸���Լ���д��ѧʽ��������۲쵽����������Һ��Ѫ��ɫ��ʵ����ۣ�֤���̷���Ʒ�ѱ�������
�ڷ���2��ȡ������Һ�����뼸������KMnO4��Һ������۲쵽�������� �� ʵ����ۣ�֤���̷���Ʒ��ȫ��������
��ʹ��FeSO4ʱ����Ҫ��ֹFe3+�ĸ��ţ����Լ����������۽��г��ӣ�д���������ۺ�����Ӧ�����ӷ���ʽ ��
��Ҫ��FeSO4��Һ�еõ��̷����壬������е�ʵ��������裺����ȴ�ᾧ�����ˡ���Ȼ�������һϵ�в�����û���õ������������˿�����ţ�
A�������� B��ʯ���� C���ձ� D��������
��2��������2�������̷��ķ�Ӧ����ʽ��2��FeSO47H2O���TFe2O3+SO2��+SO3��+14H2O��ҵ�ϳ�ͨ�����·ֽ�FeSO4�ķ����Ʊ�Fe2O3 �� Ϊ����FeSO4���·ֽ������������Ƿ���SO2��SO3 �� ��������ʵ�飺��FeSO4���·ֽ����������ͨ����ͼ��ʾ��װ���У���ش��������⣺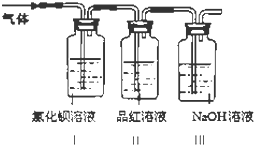
��װ��I���Ȼ�����Һ�пɹ۲쵽���� �� ���Ȼ�����Һ��������������ó������ˡ�ϴ�ӡ���ɺ����Ϊ2.33�ˣ��������̷��Ĺ�����ת����mol�ĵ��ӣ�
��װ��II���Լ�ΪƷ����Һ����������
��װ��III���Լ�ΪNaOH��Һ���������� ��
���𰸡�
��1��KSCN����Һ����ɫ��Fe+2Fe3+=3Fe2+������Ũ����B
��2���а�ɫ����������0.02������������������Ƿ�SO2����ȥ�����SO2 �� ��ֹ��Ⱦ����
����������1��������1�����̷��е��������ӱ������������ӣ���KSCN���ɫ����˼���KSCN��Һ������Һ���֤�������������Դ��ǣ�KSCN��������KMnO4�������������ӣ������������ӷ�Ӧ������Һ����ɫ����ȥ��֤������ȫ�����������Դ��ǣ���Һ����ɫ�������������ӷ�Ӧ�����������ӣ����ӷ���ʽΪFe+2Fe3+=3Fe2+ �� ���Դ��ǣ�Fe+2Fe3+=3Fe2+���ܴ���Һ�еõ�����ĵ�һ��������Ũ����Ȼ����ȴ�ᾧ�����ˡ���Ȼ���T�ɣ���һϵ�еIJ�����A���������н���������C���ձ��������Һ��D���ò��������н��裬û���õ���Bʯ���������Դ��ǣ�����Ũ����B����2��������2��Ϊ����FeSO4���·ֽ������������Ƿ���SO2��SO3 �� ��ʵ��װ�ÿ�֪���������I�з�Ӧ���ɰ�ɫ�������ᱵ��II�ж��������ʹƷ����ɫ��IIIΪβ������װ�ã�������NaOH��Һ���ն������������������Ȼ�����Һ��Ӧ�������ᱵ��ɫ����������װ��I���Ȼ�����Һ�пɹ۲쵽�������а�ɫ����������2.33gΪ���ᱵ�������ʵ���Ϊ ![]() =0.01mol����������������ʵ���Ϊ0.01mol������2��FeSO47H2O���TFe2O3+SO2��+SO3��+14H2O��2e����֪�ù�����ת�Ƶ��ӵ����ʵ���Ϊ0.02mol�����Դ��ǣ��а�ɫ����������0.02����װ��II���Լ�ΪƷ����Һ���������Ǽ���������������Ƿ�SO2 �� ���Դ��ǣ�����������������Ƿ�SO2����װ��III���Լ�ΪNaOH��Һ���������dz�ȥ�����SO2 �� ��ֹ��Ⱦ���������Դ��ǣ���ȥ�����SO2 �� ��ֹ��Ⱦ������
=0.01mol����������������ʵ���Ϊ0.01mol������2��FeSO47H2O���TFe2O3+SO2��+SO3��+14H2O��2e����֪�ù�����ת�Ƶ��ӵ����ʵ���Ϊ0.02mol�����Դ��ǣ��а�ɫ����������0.02����װ��II���Լ�ΪƷ����Һ���������Ǽ���������������Ƿ�SO2 �� ���Դ��ǣ�����������������Ƿ�SO2����װ��III���Լ�ΪNaOH��Һ���������dz�ȥ�����SO2 �� ��ֹ��Ⱦ���������Դ��ǣ���ȥ�����SO2 �� ��ֹ��Ⱦ������


 �����ҵ���������ϵ�д�
�����ҵ���������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ȷ�Ӧ������һ����Ҫ���ʣ�ijУ��ѧ��ȤС��ͬѧΪ�˿˷���ͳ���ȷ�Ӧֽ©����ȼ�գ����������ȱ�㣬��ʵ���ij�����װ�ã�ȡ��������������ͼAʵ��������ȷ�Ӧ����ȴ�������顱����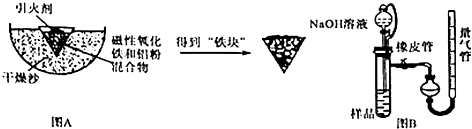
��1��ʵ���п��������Ǻ�Ũ�������þ�������������ԭ���� ��
��2�������ȷ�Ӧ�Ļ�ѧ����ʽΪ ��
��3��ȡ��Ӧ��ġ����顱����ȡ��������������ͼBװ�ã���������NaOH��Һ��ַ�Ӧ������������������Բ�����Ʒ�в������İٷֺ������Իش��������⣺�������ܵ����߲�����һ����ѧʵ�鳣�����߸�װ���ɣ�������������Ϊ ��
���������ڶ���ʱ������еIJ����� ��
��ȡ1g��Ʒ��������ʵ�飬���ռ���44.8mL���壨����ɱ�״���£��������İٷֺ���Ϊ ��
��װ���з�Һ©���϶˺���ƿ������ͨ�����˿���ƽ��ѹǿ��Һ��˳�������Թ�֮�⣬����������ʵ���������ã����װ��û���ܣ�������İٷֺ����������ƫ��ƫС������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijУ��ѧ�о���ѧϰС�������������ṩ������װ�ú�ҩƷ��ȡNaHCO3��Һ���������ʵ�飮ʵ�����ṩ��ҩƷ������װ�����£�ҩƷ����2% NaOH��Һ ��ϡHCl ��ϡH2SO4 �ܱ���KHCO3��Һ ��ŨH2SO4 ��CaCO3���� ��K2CO3��ĩ
����װ�ã���ͼ��ʾ����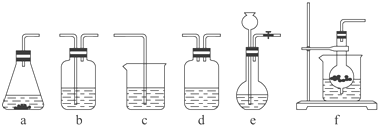
�������ĿҪ������������⣺
��1���밴�±�Ҫ����дѡ���װ�ú�ҩƷ��
���� | CO2����װ�ã��濪���ã������ͣ����X�� | ����ϴ��װ�ã�Y�� | �Ʊ���Ʒװ�ã�Z�� |
ѡ���װ�ã�����ţ� | c | ||
ѡ���ҩƷ������ţ� | �� |
��2����μ�����ѡ���CO2����װ�ã�X���������ԣ���д����Ҫ�������̣� ��
��3����װ�ð�X��Y��Z˳�����Ӳ���������Ժ�����ҩƷʵ��ʱ��Xװ���з�����ѧ��Ӧ�����ӷ���ʽΪ �� Yװ���г�ȥ������Ϊ ��
��4�������£���Zװ�õ�NaOH��Һ��ͨ�����CO2���壬��Ŀ���� ��
��5����Ҫ��֤Zװ���в��������壨�����ǹ�������Һ���⣩��NaOH��Һ���Ũ�Ȳ��ܳ���%�������������������й������ڳ��£�25�棩ʱ���ܽ��
��ѧʽ | Na2CO3 | NaHCO3 | NaOH | NaCl | Na2SO4 |
�ܽ�ȣ�g/100g H2O�� | 21.3 | 9.60 | 107 | 35.8 | 19.4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1L��Һ�к���Fe��NO3��3��H2SO4�������ʣ���Ũ�ȷֱ�Ϊ0.2mol/L��1.5mol/L���������Һ�м���39.2g����ʹ���ַ�Ӧ�������й�˵����ȷ���ǣ� ��
A.��Ӧ����Һ��Fe3+���ʵ���Ϊ0.8mol
B.��Ӧ�����13.44L H2����״����
C.��Ӧ����Һ��Fe2+��Fe3+���ʵ���֮��Ϊ0.9mol
D.����������Fe3+��H+ �� �ʷ�Ӧ����û������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ϩ��һ����Ҫ�Ļ���ԭ�ϣ�2000���������ҹ���ϩ��ʹ�����ѳ�����ϩ����һֱ�����������ƣ����Ա�ϩΪԭ�ϣ��ϳɻ���J�� 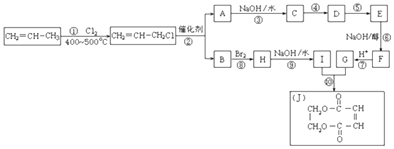
��֪��ϩ�����ֽⷴӦ��ָ�ڴ��������£�ʵ�� ![]() �����Ż�λ�ķ�Ӧ����������ϩ���ӽ���ϩ����λ�����ɶ�ϩ����ϩ��
�����Ż�λ�ķ�Ӧ����������ϩ���ӽ���ϩ����λ�����ɶ�ϩ����ϩ��
2CH2�TCHCH3 ![]() CH3CH�TCHCH3+CH2�TCH2
CH3CH�TCHCH3+CH2�TCH2
�밴Ҫ����գ�
��1����Ӧ�ٵĻ�ѧ��Ӧ������ ��
��2����Ӧ������HCl�ӳɣ������һ����Ӧ��Ŀ���� ��
��3����Ӧ�ڵĻ�ѧ����ʽΪ ��
��4������E�Ľṹ��ʽ�� ��
��5���л�������C�ж���ͬ���칹�壬��д�����������������ܷ���������Ӧ������ͬ���칹��Ľṹ��ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������� ![]() ��������۷���Ϣ�صijɷ�֮һ�������㽶����ζ��ʵ�����Ʊ������������ķ�Ӧװ��ʾ��ͼ���йصļ��Ⱥͼг�������ȥ�����й��������£�
��������۷���Ϣ�صijɷ�֮һ�������㽶����ζ��ʵ�����Ʊ������������ķ�Ӧװ��ʾ��ͼ���йصļ��Ⱥͼг�������ȥ�����й��������£�
ʵ�鲽�裺����ƿ�м���4.4g�����촼��6.0g�����ᡢ����Ũ�����2��3Ƭ���Ƭ����ʼ����������ƿ������50���ӣ���ӦҺ�������º����Һ©���У��ֱ�������ˮ������̼��������Һ��ˮϴ�ӣ��ֳ��IJ������������ˮ����þ���壬����Ƭ�̣����˳�ȥ����þ���壬�����������ռ�140��143����֣�������������2.6g���ش��������⣺
��Է������� | �ܶ�/��gcm��3�� | �е�/�� | ˮ���ܽ��� | |
���촼 | 88 | 0.8123 | 131 | �� |
���� | 60 | 1.0492 | 118 | �� |
���������� | 130 | 0.8670 | 142 | ���� |
��1��д����ȡ�����������Ļ�ѧ����ʽ ��
��2�������ܵ������ǣ����Ƭ�������� ��
��3������������������ƫ�ͣ���ԭ�������������ţ���
A.ԭ��û�г�ַ�Ӧ
B.�����˸���Ӧ
C.�ڽ�����������ʱ����143�濪ʼ�ռ����
��4����ϴ�ӡ���Һ�����У�Ӧ�����Ȼ���ã����ֲ��������ţ���
A.ֱ�ӽ������������ӷ�Һ©���Ͽڵ���
B.ֱ�ӽ������������ӷ�Һ©���¿ڷų�
C.�Ƚ�ˮ��ӷ�Һ©�����¿ڷų����ٽ��������������¿ڷų�
D.�Ƚ�ˮ��ӷ�Һ©�����¿ڷų����ٽ��������������Ͽڷų�
��5��ʵ���м���������ˮ����þ��Ŀ���� ��
��6����ʵ��IJ�����������ţ�
A.30%
B.40%
C.50%
D.60%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͬ������Na��Mg��Al�ֱ������������ַ�Ӧ������������������Ϊ�� ��
A.1��2��3
B.23��24��37
C.23��12��9
D.36��69��92
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ����գ�
��1���ǻ��ĵ���ʽ��
��2��д��2��4��6���������ױ��Ľṹ��ʽ
��3��![]() ��ϵͳ�����ǣ�
��ϵͳ�����ǣ�
��4��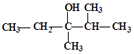 �ļ���ʽ��
�ļ���ʽ��
��5��![]() �ĵ���ṹ��ʽΪ��
�ĵ���ṹ��ʽΪ��
��6������Ũ���ᡢŨ����Ļ������60��ʱ����ȡ����Ӧ��
��7����ϩ�ڴ�������������ȡ�۱�ϩ�ķ�Ӧ����ʽ��
��8��2����������ϩ�ķ�Ӧ����ʽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ƶ������У���ȷ���ǣ� ��
A. ��������ɫ������Ӳ�Ⱥܴ�
B. �������Ʒ���ʯ�����ϣ��þƾ��Ƽ��Ⱥ����ƾ���ȼ�գ�������ɫ���棬���ɹ�������
C. �������ڿ�����ȼ�գ�����������
D. �����Ƶ��۵�ܸ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com