
将1000 mL 0.1 mol·L-1 BaCl2溶液与足量稀硫酸充分反应放出a kJ热量;将1000 mL 0.5 mol·L-1 HCl溶液与足量CH3COONa溶液充分反应放出b kJ热量(不考虑醋酸钠水解);将500 mL 1 mol·L-1 H2SO4溶液与足量(CH3COO)2Ba(可溶性强电解质)溶液反应放出的热量为
| A.(5a-2b) kJ | B.(2b-5a) kJ |
| C.(5a+2b) kJ | D.(10a+4b) kJ |
C
解析试题分析: 根据题给信息知,BaCl2溶液与足量稀硫酸充分反应的热化学方程式为:
①Ba2+(aq)+SO42-(aq)=BaSO4(s),△H=—10akJ?mol-1,HCl溶液与足量CH3COONa溶液充分反应的热化学方程式为:②H+(aq) +CH3COO—(aq)="==" CH3COOH(l),△H=—2bkJ?mol-1,根据盖斯定律,①+2×②得Ba2+(aq)+SO42-(aq)+2H+(aq) +2CH3COO—(aq)=BaSO4(s)+2CH3COOH(l),△H=—(10a+2b)kJ?mol-1,则将500 mL 1 mol·L-1 H2SO4溶液与足量(CH3COO)2Ba(可溶性强电解质)溶液反应放出的热量为(5a+2b) kJ,选C。
考点:考查热化学方程式的书写和反应热的计算。


科目:高中化学 来源: 题型:单选题
下列热化学方程式书写正确的是(ΔH的绝对值均正确) ( )
| A.C(s)+1/2O2(g)=CO(g) ΔH=-110.5kJ·mol-1 (燃烧热) |
| B.2H2O(g)=2H2(g)+O2(g) ΔH=+483.6 kJ·mol-1(反应热) |
| C.C2H5OH+3O2=2CO2+3H2O ΔH=-1368.8 kJ·mol-1(反应热) |
| D.2NaOH(aq)+H2SO4(aq)=Na2SO4 (aq)+2H2O(l) ΔH=-114.6 kJ·mol-1(中和热) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
碘在不同状态下(固态或气态)与氢气反应的热化学方程式如下所示:
①H2(g) + I2(?) 2HI(g)+9.48kJ
2HI(g)+9.48kJ
②H2(g) + I2(?) 2HI(g)-26.48kJ
2HI(g)-26.48kJ
下列判断正确的是
| A.①中的I2为固态,②中的I2为气态 |
| B.②的反应物总能量比①的反应物总能量低 |
| C.①的产物比反应②的产物热稳定性更好 |
| D.1mol 固态碘升华时将吸热17kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
工业上采用NH3作还原剂脱氮原理为:
NO(g)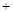 NO2(g)
NO2(g)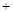 2NH3(g)
2NH3(g)  2N2(g)
2N2(g)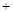 3H2O(g),
3H2O(g),
烟气以一定的流速通过,测量不同温度下逸出气体中氮氧化物含量,从而确定烟气效率,右图是两种不同催化剂的脱氮效率曲线,判断以下分析正确的是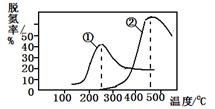
| A.上述反应的正反应为吸热反应 |
| B.催化剂①、②分别适合于250℃和450 ℃左右脱氮 |
| C.曲线①、②最高点表示此时平衡转化率最高 |
| D.相同条件下,改变压强对脱氮率没有影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
生物质(通过光合作用产生的有机体)是一种可再生能源,能发生如下图转化。下列说法不正确的是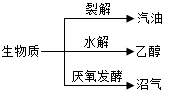
| A.汽油属于纯净物 |
| B.乙醇属于可再生能源 |
| C.沼气的主要成分是甲烷 |
| D.生物质能来源于太阳能 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法正确的是
| A.需加热才能发生的反应一定是吸热反应 |
| B.任何放热反应在常温条件一定能发生反应 |
| C.反应物和生成物分别具有的总能量决定了反应是放热反应还是吸热反应 |
| D.当△H<0时表明反应为吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列依据热化学方程式得出的结论正确的是
| A.已知C(石墨,s)=C(金刚石,s) ΔH>0,则金刚石比石墨稳定 |
| B.已知C(s)+O2(g)=CO2(g) ΔH1 C(s)+1/2O2(g)=CO(g);ΔH2,则ΔH2>ΔH1 |
| C.已知2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ/mol,则氢气的燃烧热为241.8 kJ/mol |
| D.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=-57.3 kJ/mol,则含20 g NaOH的稀溶液与稀盐酸完全中和,中和热为28.65 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
能够表示燃烧热的是( )
| A.2H2(g)+O2(g)=2H2O(g);△H1 |
| B.S(g)+O2(g)= SO2 (g);△H1 |
C.C(s)+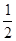 O2(g)= CO(g);△H1 O2(g)= CO(g);△H1 |
| D.H2(g)+Cl2(g) = 2HCl(g);△H1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
(1)已知:① TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g) ΔH=+140 kJ·mol-1
②2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1
写出TiO2和焦炭、氯气反应生成液态TiCl4和CO气体的热化学方程式:________________。
(2)有一类甲醇质子交换膜燃料电池,需将甲醇蒸气转化为氢气,两种反应原理是:
A.CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
B.CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) ΔH=-676.7 kJ·mol-1
由上述方程式可知,CH3OH的标准燃烧热________(填“大于”“等于”“小于”或“不能确定”)-676.7 kJ·mol-1。已知水的气化热为44 kJ·mol-1,则氢气燃烧的热化学方程式为__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com