
【题目】根据能量示意图,下列判断正确的是( )
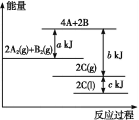
A.化学反应中断键要放出能量,形成化学键要吸收能量
B.该反应的反应物总能量小于生成物总能量
C.2A2(g)+B2(g)= 2C(g)ΔH=-(b+c-a)kJ·mol-1
D.由图可知,生成1 mol C(l),放出![]() (b+c-a)kJ热量
(b+c-a)kJ热量
科目:高中化学 来源: 题型:
【题目】某化学课外活动小组通过实验探究NO2的性质。已知:2NO2+2NaOH===NaNO3+NaNO2+H2O。
任务1:利用如图所示装置探究NO2能否被NH3还原(夹持固定装置已略去)。

请回答下列问题:
(1)E装置中制取NO2的化学方程式是_____________________________。
(2)若NO2能被NH3还原,预期观察到C装置中的现象是________________。
(3)此实验装置存在的一个明显缺陷是_______________________________________。
任务2:探究NO2能否与Na2O2发生氧化还原反应。
(4)实验前,该小组同学提出三种假设。
假设1:二者不反应;
假设2:NO2能被Na2O2氧化;
假设3:________________________________________________。
(5)为了验证假设2,该小组同学选用任务1中的B、D、E装置,将B中的药品更换为Na2O2,另选F装置(如图所示),重新组装,进行实验。
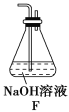
①装置的合理连接顺序是(某些装置可以重复使用)_________________。
②实验过程中,B装置中淡黄色粉末逐渐变成白色。经检验,该白色物质为纯净物,且无其他物质生成。推测B装置中发生反应的化学方程式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(乙二酸)存在于自然界的植物中,其K1=5.4×10﹣2,K2=5.4×10﹣5。草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水。草酸晶体(H2C2O42H2O)无色,熔点为101℃,易溶于水,受热脱水、升华,170℃以上分解。回答下列问题:
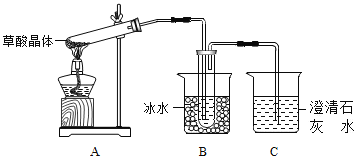
(1)草酸中含有的官能团名称是______。
(2)甲组同学按照如图所示的装置,通过实验检验草酸晶体的分解产物,装置C中可观察到的现象是______,由此可知草酸晶体分解的产物中有_____。装置B的主要作用是_______。
(3)乙组同学认为草酸晶体分解的产物中含有CO,为进行验证,选用甲组实验中的装置A、B和如图所示的部分装置(可以重复选用)进行实验。

①乙组同学的实验装置中,依次连接的合理顺序为A、B、_____。装置H反应管中盛有的物质是_____(填化学式)。
②能证明草酸晶体分解产物中有CO的现象是____________;
(4)设计实验:①证明草酸的酸性比碳酸的强(简述操作步骤和现象,下同)______;
②用简单的方法鉴别草酸和甲酸______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下的恒容容器中,下列哪些物理量不再发生变化时,不能表明反应A(g)+2B(g)![]() C(g)+D(g)已达到化学平衡状态
C(g)+D(g)已达到化学平衡状态
A.混合气体的密度
B.混合气体的物质的量
C.B的物质的量浓度
D.混合气体的平均相对分子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为一原电池工作原理示意图,电池工作过程中左右两烧杯所盛放的溶液中不允许引入杂质。下列有关说法中正确的是( )

A.所用离子交换膜为阳离子交换膜
B.Cu电极的电极反应为Cu-2e-=Cu2+
C.电池工作过程中,CuCl2溶液浓度降低
D.Fe为负极,电极反应为Fe2++2e-=Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用下图所示装置进行液体石蜡分解及其产物性质实验。下列操作或叙述错误的是
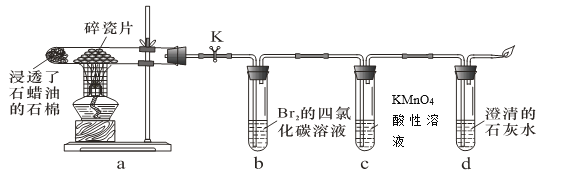
A.装置b、c中发生反应的基本类型不同B.d中溶液变浑浊证明石蜡分解产生了CO2
C.实验中可以看到b、c中溶液褪色D.停止加热后立即关闭K可以防止液体倒吸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气具有还原性,能够被氧化铜氧化,用如图中的装置可以实现该反应。

已知:氨可以与灼热的氧化铜反应得到氮气和金属铜。回答下列问题:
(1)B中加入的干燥剂是____(填序号)。
①浓硫酸 ②无水氯化钙 ③碱石灰
(2)能证明氨与氧化铜反应的现象是C中________。
(3)D中有无色液体生成。设计实验检验D中无色液体的成分:__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)对于下列反应:2SO2 +O2![]() 2SO3,如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么用O2浓度变化来表示的反应速率为________。如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L·min),那么2min时SO2的浓度为_______。
2SO3,如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么用O2浓度变化来表示的反应速率为________。如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L·min),那么2min时SO2的浓度为_______。
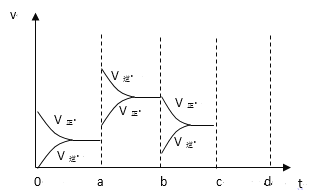
(2)下图左表示在密闭容器中反应:2SO2+O2![]() 2SO3+Q达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a-b过程中改变的条件可能是_____;b-c过程中改变的条件可能是________;若增大压强时,反应速度变化情况画在c~d处。_______
2SO3+Q达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a-b过程中改变的条件可能是_____;b-c过程中改变的条件可能是________;若增大压强时,反应速度变化情况画在c~d处。_______
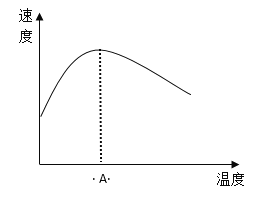
(3)酶是蛋白质,具有蛋白质的特性,酶能催化很多化学反应,下图表示酶参加的反应中,温度与反应速率的关系。解释曲线变化原因 __________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国化学家研究的一种新型复合光催化剂![]() 碳纳米(CQDs)/氮化碳(C3N4)纳米复合物
碳纳米(CQDs)/氮化碳(C3N4)纳米复合物![]() 可以利用太阳光实现高效分解水,其原理如图所示。下列说法正确的是
可以利用太阳光实现高效分解水,其原理如图所示。下列说法正确的是
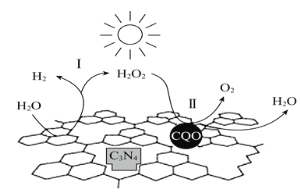
A.C3N4中C的化合价为-4
B.反应的两个阶段均为非氧化还原
C.阶段Ⅱ中,H2O2既是氧化剂,又是还原剂
D.通过该反应,实现了化学能向太阳能的转化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com