
【题目】能源是人类生活和社会发展的基础,研究化学反应中的能量变化,有助于更好地利用化学反应为生产和生活服务,回答有关问题:
(1)在一定条件下,2H2O==2H2↑+O2↑,下图能正确表示该反应中能量变化的是________(用A、B表示)。

从断键和成键的角度分析上述反应中能量的变化。化学键的键能如下表:则生成1mol水热量变化为________kJ。
化学键 | H—H | O=O | H—O |
键能kJ/mol | 436 | 496 | 463 |
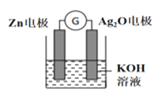
(2)在生产和生活中经常遇到化学能与电能的相互转化,银锌电池是一种常见化学电源,其反应原理:Zn+Ag2O+H2O=Zn(OH)2+2Ag,其工作示意如图所示。在装置中Ag2O作_______极(填正或负)溶液中的K+向_____电极移动(填“Zn”或“Ag2O”);Ag2O电极发生______(还原或氧化反应),电极反应式为_____________________。
(3)一定温度下,将3molA气体和1molB气体通入一容积固定为1L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g),反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,则1min内,B的平均反应速率为_______;x为_________;此时反应物B的转化率为_________。若反应经2min达到平衡,平衡时C的浓度_____0.8mol/L(填“大于,小于或等于”)。
xC(g),反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,则1min内,B的平均反应速率为_______;x为_________;此时反应物B的转化率为_________。若反应经2min达到平衡,平衡时C的浓度_____0.8mol/L(填“大于,小于或等于”)。
【答案】B 242 正极 Ag2O 还原 Ag2O+2e-+H2O=2Ag+2OH- 0.4mol/(L·min) 1 40% 小于
【解析】
(1)在一定条件下,2H2O==2H2↑+O2↑,属于分解反应,为吸热反应,反应物的总能量小于生成物的总能量,能正确表示该反应中能量变化的是B;根据2H2+O2=2H2O反应,断裂2molH2中的化学键吸收2×436kJ热量,断裂1molO2中的化学键吸收496kJ热量,共吸收2×436+496=1368kJ热量,形成4molH-O键释放4×463kJ=1852kJ热量,2mol H2在氧气中燃烧生成2mol水的反应热△H=反应物中键能之和-生成物中键能之和=1368-1852kJ/mol=-484kJ/mol,即 H2在氧气中燃烧生成1mol水放出的热量为242kJ;答案为B,242。
(2)根据银锌电池反应原理:Zn+Ag2O+H2O=Zn(OH)2+2Ag,Zn由0价失电子变为+2价,Ag2O中的银由+1价得电子变0价,就可判断活泼金属Zn为负极,Ag2O是正极,原电池中阳离子向正极移动,所以K+朝正极即Ag2O移动,由于Ag2O是正极,发生得电子的还原反应,电极反应为Ag2O+H2O+2e-=2Ag+2OH-;答案为正极,Ag2O,还原,Ag2O+H2O+2e-=2Ag+2OH-。
(3)反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,参加反应的A的物质的量为3mol-1.8mol=1.2mol,由方程式可知,参加反应的B为1.2mol×![]() =0.4mol,则1min内,B的平均反应速率为
=0.4mol,则1min内,B的平均反应速率为 =0.4mol/(L.min);生成的C为0.4mol/L×1L=0.4mol,故1.2mol:0.4mol=3:x,解得x=1;B的转化率=
=0.4mol/(L.min);生成的C为0.4mol/L×1L=0.4mol,故1.2mol:0.4mol=3:x,解得x=1;B的转化率= ![]() ×100%=
×100%=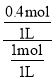 ×100%=40%;随着反应的进行,反应速率逐渐减小,若反应经2min达到平衡,后1min的平均速率小于前1min的平均速率,前1min内C的浓度变化为0.4mol/L,则后1min内C的浓度变化小于0.4mol/L,故平衡时C的浓度小于0.8mol/L;答案为0.4mol/(Lmin), 1,40%,小于。
×100%=40%;随着反应的进行,反应速率逐渐减小,若反应经2min达到平衡,后1min的平均速率小于前1min的平均速率,前1min内C的浓度变化为0.4mol/L,则后1min内C的浓度变化小于0.4mol/L,故平衡时C的浓度小于0.8mol/L;答案为0.4mol/(Lmin), 1,40%,小于。


科目:高中化学 来源: 题型:
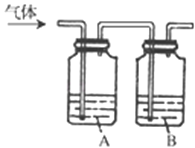
【题目】为了确定三种可燃性气体:CH4、H2和CO(简称试验气),分别将它们在O2中燃烧,再将燃烧后的产物分别依次通过图中A、B两个洗气瓶.
试回答:
(1)装置A中的液体是______,装置B中的液体是______;
(2)若装置A的质量增加,B的质量不变,则待测试验气是______;
(3)若装置A质量不变,B的质量增加,则试验气是______;
(4)若装置A、B的质量都增加,则试验气是______,若这时装置B的质量增加m g,则装置A的质量增加______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下的恒容容器中,下列哪些物理量不再发生变化时,不能表明反应A(g)+2B(g)![]() C(g)+D(g)已达到化学平衡状态
C(g)+D(g)已达到化学平衡状态
A.混合气体的密度
B.混合气体的物质的量
C.B的物质的量浓度
D.混合气体的平均相对分子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用下图所示装置进行液体石蜡分解及其产物性质实验。下列操作或叙述错误的是
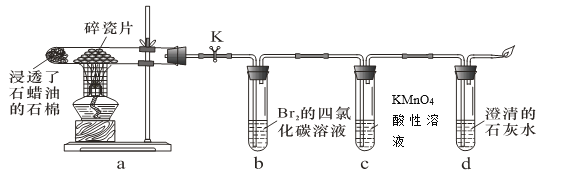
A.装置b、c中发生反应的基本类型不同B.d中溶液变浑浊证明石蜡分解产生了CO2
C.实验中可以看到b、c中溶液褪色D.停止加热后立即关闭K可以防止液体倒吸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气具有还原性,能够被氧化铜氧化,用如图中的装置可以实现该反应。

已知:氨可以与灼热的氧化铜反应得到氮气和金属铜。回答下列问题:
(1)B中加入的干燥剂是____(填序号)。
①浓硫酸 ②无水氯化钙 ③碱石灰
(2)能证明氨与氧化铜反应的现象是C中________。
(3)D中有无色液体生成。设计实验检验D中无色液体的成分:__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋是个巨大的资源宝库,它不仅孕育着无数的生命,还蕴藏着丰富的矿产,海水中含有大量的化学物质,是宝贵的化学资源。海水素有“液体工业原料”的美誉,可从海水中提取大量的食盐、镁、溴、碘、钾等有用物质。下面是海水综合利用的部分流程:

完成下列问题:
(1)下列说法错误的是________(填标号)。
A.电解饱和食盐水时阳极的电极反应式为:Cl2+2e-===2Cl-
B.苦卤制溴过程一定发生氧化还原反应
C.操作Ⅰ是蒸发结晶
D.E物质可以循环使用
(2)沉淀剂A来源于石灰窑厂,写出A的化学式:A_______________。
(3)实验室提纯粗盐的实验操作依次为:取样、________、沉淀、过滤、________。
(4)工业生产纯碱的工艺流程中,碳酸化时产生的现象为___________,发生反应的化学方程式是____________,其原因是______________。
(5)碳酸化后过滤,滤液D最主要的成分是________(填写化学式),检验这一成分的阴离子的具体方法是___________。向滤液D中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用是________(填标号),这样做可使原料氯化钠的利用率从70%提高到90%以上。
a.增大NH![]() 的浓度,使NH4Cl更多地析出
的浓度,使NH4Cl更多地析出
b.使NaHCO3更多地析出
c.使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
(6)用加热分解的方法测定产品纯碱的纯度,若取m1 g纯碱样品,实验结束后称得固体质量为m2 g,则纯碱的纯度为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)对于下列反应:2SO2 +O2![]() 2SO3,如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么用O2浓度变化来表示的反应速率为________。如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L·min),那么2min时SO2的浓度为_______。
2SO3,如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么用O2浓度变化来表示的反应速率为________。如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L·min),那么2min时SO2的浓度为_______。
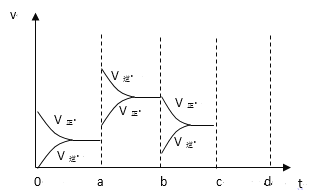
(2)下图左表示在密闭容器中反应:2SO2+O2![]() 2SO3+Q达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a-b过程中改变的条件可能是_____;b-c过程中改变的条件可能是________;若增大压强时,反应速度变化情况画在c~d处。_______
2SO3+Q达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a-b过程中改变的条件可能是_____;b-c过程中改变的条件可能是________;若增大压强时,反应速度变化情况画在c~d处。_______
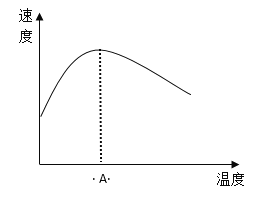
(3)酶是蛋白质,具有蛋白质的特性,酶能催化很多化学反应,下图表示酶参加的反应中,温度与反应速率的关系。解释曲线变化原因 __________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物结构简式如图,下列关于该有机物的说法正确的是
![]()
①分子式为 C16H14O5 ;②能使酸性 KMnO4 溶液褪色;③能发生加成反应,但不能发生取代反应;④苯环上的一溴代物有6种;⑤1mol该有机物水解时最多能消耗4molNaOH;⑥1mol该有机物在一定条件下和 H2 反应,共消耗 6molH2。
A.①②③⑥B.①②⑤C.①④⑤⑥D.①②④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酰氯(SO2Cl2)熔点-54.1℃、沸点69.2℃,在染料、药品、除草剂和农用杀虫剂的生产过程中有重要作用。
(1)SO2Cl2中S的化合价为___________,SO2Cl2在潮湿空气中因水解“发烟”的化学方程式为__________。
(2)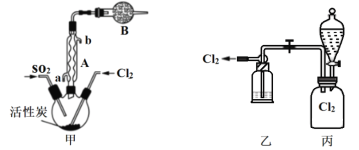
①仪器A的名称为___________,装置B的作用是____________。
②装置乙中装入的试剂是浓硫酸,装置丙分液漏斗中盛装的最佳试剂是________(选填字母)。
A.蒸馏水 B.10.0 molL1浓盐酸 C.浓氢氧化钠溶液 D.饱和食盐水
③滴定法测定硫酰氯的纯度:取1.800g产品,加入到100mL 0.5000mol·L1 NaOH溶液中加热充分水解,冷却后加蒸馏水准确稀释至250mL,取25mL溶液于锥形瓶中,滴加2滴甲基橙,用0.1000mol·L1标准HCl滴定至终点,重复实验三次取平均值,消耗10.00mL滴定终点的判断为___________,产品的纯度为_________。
(3)探究硫酰氯在催化剂作用下加热分解的产物,实验装置如图所示(部分夹持装置未画出)。

①加热时A中试管出现黄绿色,装置B的作用是_________。
②装置C中反应的离子方程式为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com