
 在人类社会的发展进程中,金属起着重要的作用.
在人类社会的发展进程中,金属起着重要的作用.分析 (1)A.钠化学性质比较活泼,需要隔绝空气密封保存;
B.生成的氧化铝薄膜熔点高未熔化,包裹着的内层熔化的铝而不会滴落;
C.铁与水蒸气反应生成的是四氧化三铁;
(2)向水中固体组成的混合物溶液中加入盐酸时,0-A时没有沉淀生成,说明溶液中NaOH过量,则铝离子完全转化为偏铝酸根离子,溶液中存在的沉淀为Mg(OH)2;
A-B段,盐酸和偏铝酸钠反应生成氢氧化铝沉淀,离子反应方程式为H2O+AlO2-+H+=Al(OH)3↓,B点溶液中存在的溶质是氯化钠,沉淀为Mg(OH)2、Al(OH)3;
B-C过程中,氢氧化镁和氢氧化铝都与盐酸反应生成氯化铝和氯化镁,所以C点溶液中的溶质是氯化铝、氯化镁和氯化钠,据此进行解答.
解答 解:(1)A.钠的化学性质非常活泼,保存时需要隔绝空气密封保存,在实验室中通常保存在石蜡油或煤油中,故A正确;
B.用坩埚钳夹住一小块铝箔,由于铝熔点低,所以在酒精灯上加热铝熔化,失去了光泽,由于氧化铝熔点较高,加热时氧化膜包裹着的内层熔化的铝而不会滴落,故B错误;
C.铁单质与水蒸气反应生成四氧化三铁,正确的化学方程式为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$ Fe3O4+4H2,故C错误;
故答案为:A;
(2)①向水中固体组成的混合物溶液中加入盐酸时,0-A时没有沉淀生成,说明溶液中NaOH过量,溶液中铝离子完全转化为偏铝酸根离子,溶液中存在的沉淀为Mg(OH)2,
故答案:Mg(OH)2;
②A-B段,盐酸和偏铝酸钠反应生成氢氧化铝沉淀,离子反应方程式为:H2O+AlO2-+H+=Al(OH)3↓,
故答案:H2O+AlO2-+H+=Al(OH)3↓;
③某溶液中溶有MgCl2和AlCl3两种溶质,若把两者分开,可以先加入过量氢氧化钠溶液,反应生成氢氧化镁沉淀和偏铝酸钠,通过过量分离出氢氧化镁沉淀,然后用稀盐酸将氢氧化镁转化成氯化镁;向偏铝酸钠溶液中通入二氧化碳气体,反应生成氢氧化铝,过滤后得到氢氧化铝沉淀,用稀盐酸将氢氧化铝转化成氯化铝,所以需要使用的试剂为:NaOH溶液、CO2、稀盐酸,
故答案为:NaOH溶液、CO2、稀盐酸;
④A点沉淀的是氢氧化镁,则n(Mg(OH)2)=$\frac{1.16g}{58g/mol}$=0.02mol,根据Mg原子守恒得n(MgCl2)=n(Mg(OH)2)=0.02mol;A-B段,盐酸和偏铝酸钠反应生成氢氧化铝沉淀,离子反应方程式为H2O+AlO2-+H+=Al(OH)3↓,根据HCl的体积知,n(AlO2-)=n(HCl)=1mol/L×(0.03-0.01)L=0.02mol;根据铝原子守恒得n(AlCl)=n(AlO2-)=0.02mol,由Na+离子和Cl-离子守恒得,原混合物中n(NaOH)=n(NaCl)=n(Cl-)=2n(MgCl2)+3n(AlCl3)+n(HCl)=0.02mol×2+0.02mol×3+0.03L×1mol/L=0.13mol,氢氧化钠的质量=0.13mol×40g/mol=5.2g;
C点溶液为MgCl2、AlCl3和NaCl混合液,C点所加盐酸用于中和原混合物中的NaOH,此时所加盐酸物质的量:
n(HCl)=n(NaOH)=0.13mol;P点所表示盐酸的体积为:V=$\frac{0.13mol}{1mol/L}$=0.13L=130ml,
故答案为:5.2;130.
点评 本题考查了金属单质及其化合物的综合应用,题目难度中等,明确常见金属单质及其化合物性质为解答关键,注意掌握守恒思想在化学计算中的应用方法,试题培养了学生的分析能力及化学计算能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 3mol NF3(F元素为-1价)与水完全反应生成HF、HNO3和NO,转移电子数2NA | |
| B. | 22.4L CO2与过量的Na2O2反应,转移的电子数为NA | |
| C. | 物质的量浓度为0.3mol/L的BaCl2溶液中,含有Cl- 个数为0.6 NA | |
| D. | 常温下,5.6g铁钉与足量浓硝酸反应,转移的电子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Na+、MnO4-、SO42- | |
| B. | I-、Na+、NO3-、ClO- | |
| C. | Mg2+、Na+、NO3-、SO42- | |
| D. | 加入Al能放出H2的溶液中:Cl-、HCO3-、SO42-、NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4 | B. | 5 | C. | 6 | D. | 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0 mol•L-1的KNO3溶液:H+、Fe2+、Cl-、SO42- | |
| B. | c(H+)/c(OH-)=1012的溶液中:NH4+、Al3+、NO3-、Cl- | |
| C. | 由水电离的c(H+)=1×10-13mol/L溶液中:K+、Na+、AlO2-、CO32- | |
| D. | 含1.0mol•L-1Al3+的溶液中:Na+、HCO3-、SO42-、Mg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
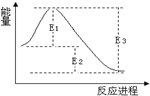
| A. | 该反应常温下一定可以自发进行 | |
| B. | 使用催化剂可以改变E1、E2、E3的大小,从而改变正逆反应速率 | |
| C. | E2为该反应的焓变,且该反应的△H<0 | |
| D. | 该反应反应物能量大于生成物能量,故可设计成原电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 过滤时,玻璃棒与三层滤纸的一边接触 | |
| B. | 向试管中滴加液体时,胶头滴管紧贴试管内壁 | |
| C. | 浓硫酸不慎滴到皮肤上,先用较多的水冲洗,再涂上3%~5%的碳酸氢钠溶液 | |
| D. | 除去粗盐中的硫酸盐应加入BaCl2溶液,离子反应为Ba2++SO42-═BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (或
(或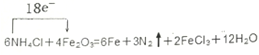 );
);查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com