
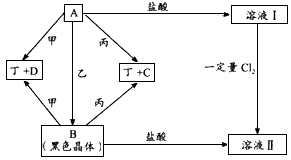
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
现有甲、乙、丙、丁四支试管,甲、丁中均盛有1mL的酸性KMnO4溶液、乙、丙中分别盛有2mL溴水+2g FeBr3、2mL Br2的CCl4溶液+2g FeBr3,再向甲、乙中加入适量苯,丙、丁中加入适量甲苯,充分振荡后静置.下列有关分析中正确的一组是( )
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源:2010-2011年北京市师大附中高一下学期期中考试化学试卷 题型:填空题
现有甲、乙、丙、丁四种短周期元素,甲元素M电子层上的电子数是K电子层上电子数的一半,乙元素的单质在室温下,冷的浓硫酸或空气中表面都能生成致密的氧化膜;丙元素的单质在常温下是黄绿色气体;丁元素的二价阴离子与丙元素的阴离子具有相同的电子层结构。
(1)写出甲、乙、丙、丁四种元素的符号。
甲_________、乙_________、丙__________、丁__________。
(2)甲元素和乙元素最高价氧化物对应的水化物碱性较强的是__________(填化学式)。
(3)将过量的丙元素的单质通入FeBr2溶液中,发生反应的离子方程式是:___________________________,该反应的氧化剂是:_______________(写物质名称)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com