
����Ŀ�����Բ���A��������Ԫ����ɵĻ����ij�о�С�鰴��ͼ����̽������ɣ�
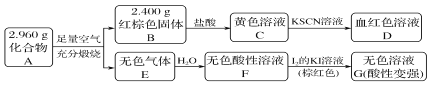
��ش�
��1��A�����Ԫ��Ϊ________(��Ԫ�ط��ű�ʾ)����ѧʽΪ_____________________��
��2����ҺC���ܽ�ͭƬ�����ٸ÷�Ӧ��һ��ʵ��Ӧ��________��
��3����֪������A����ϡ���ᷴӦ������һ�ֵ���ɫ�������һ������(����µ��ܶ�Ϊ1.518 g��L��1)����������ӵĵ���ʽΪ________��д���÷�Ӧ�����ӷ���ʽ____________________��
д��F��G��Ӧ�Ļ�ѧ����ʽ___________________________________��
���ʵ�鷽��̽����ҺG�е���Ҫ��(������H2O��H����K����I��) _____________________��
���𰸡� S��Fe Fe3S4 ��ӡˢ��·�� ![]() Fe3S4��6H��===3Fe2����3H2S����S H2SO3��I2��H2O=H2SO4��2HI ȡ��ҺG���������BaCl2��Һ����������ɫ����������SO42�������˺�ȡ��Һ���μ�H2O2��Һ�����ٲ�����ɫ����������H2SO3
Fe3S4��6H��===3Fe2����3H2S����S H2SO3��I2��H2O=H2SO4��2HI ȡ��ҺG���������BaCl2��Һ����������ɫ����������SO42�������˺�ȡ��Һ���μ�H2O2��Һ�����ٲ�����ɫ����������H2SO3
��������C����KSCN��DΪѪ��ɫ��Һ����֪CΪFeCl3��DΪFe(SCN)3 �ȣ���֪BΪFe2O3����n��Fe2O3��=2.400g/160g��mol��1=0.015mol��n��Fe��=0.03mol��m��Fe��=0.03mol��56g��mol��1=1.68g��Aȼ�����ɵ���ɫ����E��Һˮ�õ�������Һ��������KI��Һ���õ���ɫ��Һ��˵���������E��ˮ��Һ��EӦΪSO2��FΪH2SO3��G���к�H2SO4��HI����֪A����Fe��SԪ�أ���m��S��=2.96g-1.68g=1.28g��n��S��=1.28g/32g��mol��1=0.04mol����֪n��Fe����n��S��=3��4��ӦΪFe3S4����1�������Ϸ�����֪��A���Ԫ��ΪFe��S��ΪFe3S4����2�������Ӿ���ǿ�����ԣ��ɽ�ͭ��������������ӡˢ��·�壻��3��������A����ϡ���ᷴӦ������һ�ֵ���ɫ�������һ�����壨����µ��ܶ�Ϊ1.518 g��L��1��������ɫ������ΪS���������Է�������Ϊ1.518��22.4L=34��ΪH2S���壬����ʽΪ![]() ����Ӧ�����ӷ���ʽΪFe3S4+6H��=3Fe2��+S+3H2S������4��F��G��Ӧ�Ļ�ѧ����ʽΪH2SO3+I2+H2O=H2SO4+2HI����ҺG�е���Ҫ����������H2O��H����K����I���� ΪSO42����H2SO3�����ȼ���SO42�����������H2SO3���������Ϊ��ȡ��ҺG���������BaCl2��Һ����������ɫ����������SO42�������˺�ȡ��Һ���μ�H2O2��Һ�����ٲ�����ɫ����������H2SO3��
����Ӧ�����ӷ���ʽΪFe3S4+6H��=3Fe2��+S+3H2S������4��F��G��Ӧ�Ļ�ѧ����ʽΪH2SO3+I2+H2O=H2SO4+2HI����ҺG�е���Ҫ����������H2O��H����K����I���� ΪSO42����H2SO3�����ȼ���SO42�����������H2SO3���������Ϊ��ȡ��ҺG���������BaCl2��Һ����������ɫ����������SO42�������˺�ȡ��Һ���μ�H2O2��Һ�����ٲ�����ɫ����������H2SO3��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ����ӵ�������ֵ������������ȷ����(�� ��)
A. ��״���£�33.6L�������к��з�ԭ�ӵ���ĿΪ1.5NA
B. ���³�ѹ�£�7.0g��ϩ���ϩ�Ļ�����к�����ԭ�ӵ���ĿΪNA
C. 50mL 18.4mol/LŨ����������ͭ�ȷ�Ӧ������SO2������ĿΪ0.46NA
D. ij�ܱ�����ʢ��0.1molN2��0.3molH2����һ�������³�ַ�Ӧ��ת�Ƶ��ӵ���ĿΪ0.6NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����Һ����Ҫ�ɷ�ΪNaClO��������һ������NaOH����������������ʵ�ķ���ʽ�����������ǣ���֪������NaClO��Һ��pHԼΪ11���� ��
A. ������Һ����NaOH��Һ����Cl2�Ʊ���Cl2 +2OH��=== Cl��+ ClO��+ H2O
B. ������Һ��pHԼΪ12��ClO��+ H2O![]() HClO+ OH��
HClO+ OH��
C. ������Һ�����飨��Ҫ�ɷ�ΪHCl�����ã�����Cl2��2H��+ Cl��+ ClO��= Cl2 ��+ H2O
D. ������Һ�Ӱ״�����HClO������ǿƯ�����ã�CH3COOH+ ClO��= HClO+ CH3COO��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ƥ�������������״̬ʱ�ṹ��ͼ����������������з�������25����101 kPaʱ�����й��̵��ʱ䡢�ر���Է�������Ƥ�������״̬������״̬һ�µ��ǣ���

A. CaCO3=CaO+CO2�� B. NaOH���ܽ�
C. 2H2+O2=2H2O D. Ba(OH)2��8H2O+2NH4Cl=BaCl2+2NH3��+10H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��SO2�������ش�����Ⱦ�����ֱ���ŷ��ڿ����У������ִ����������£�

��֪����25��ʱ��NH3��H2O�ĵ���ƽ�ⳣ��Kb��1��8��10��5��
��������ʵ�Ksp�������±���ʾ��

��ش��������⣺
��1������1������������SO2��______________���ѧ���ʣ����ù�������Ҳ������NH4HSO3��ҺΪ�����Һ�������������ʽΪ__________________�������������Һ��Ϊ��ˮ��εķ���Ϊ__________��
��2������2�������յ��ŵ���________________________________________��
��3������2��Ϊ����������ķ���Ч����ȡ������H2SO4��Һ���Թ��У���������μ���AgNO3��Һ����ַ�Ӧ�����۲쵽___________________��֤������Ч���Ϻá�
��4��ij���д����Ȼ�������������Һ��c��Cl������0��36 mol��L��1�������������廯����Һ����Ҫ�����廯��������������廯����Һ����СŨ����____________mol��L��1��
��5����ˮ��һ����Ҫ��������ʣ������£���0��1 mol��L��ˮ�м�������NH4NO3��ʹ��Һ��c��NH3��H2O����c��NH4������5 ��9����ʱ��Һ��pH��_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������;����ȫ���ϵ��У� ��
�ٸɱ����˹����ꣻ
��Na2CO3���Ʋ�����
��Fe2O3����ɫ�����Ϳ�ϣ�
��Al2O3���ͻ���ϣ�
��NaClO����ˮ��
��NaHCO3����ʳƷ���ݼ���
��KAl��SO4��2����������ˮ��
A.�ݢ�
B.�ڢܢޢ�
C.�ۢ�
D.�٢ۢݢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��amL������̬����ɵĻ����������������Ӧ���ָ���ԭ����״̬���������С2amL������������������( )
A. CH4��C2H4��C3H4 B. C2H6��C3H6��C4H6 C. CH4��C2H6 C3H8 D. CH4��C2H4��C2H2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ɹ�ҵ��̼��ﮣ���������̼��þ�����ʣ��Ʊ��ߴ�̼��ﮡ�ʵ��������£�

��1��ʵ����������ͼ��ʾװ���н���̼����Ӧ��

�� ̼����Ӧ����Ҫ��Ӧ���ӷ���ʽΪ__________��
�� ̼��ʱ�¶�������� 30�棬�ɲ�ȡ�Ĵ�ʩ��_________�� �¶Ȳ��˹��ߵ�ԭ����________��
��2���� CO2�� pH Ϊ 8~9����Ŀ����__________��
��3����֪�ڲ�ͬ�¶��������ֽ�̼��﮵IJ������ܽ�ȹ�ϵ��ͼ��

90�����£����¶����ߣ�̼��﮲������ߵ�ԭ�������__________��
��4���벹����������Һ�Ʊ��ߴ�̼��﮵�ʵ�鷽����ȡ��Һ�������ձ���___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��ӦA(g)+B(g)![]() C(g)+D(g)��ƽ�ⳣ�����¶ȵĹ�ϵ���£�
C(g)+D(g)��ƽ�ⳣ�����¶ȵĹ�ϵ���£�
�¶�/�� | 700 | 800 | 830 | 1000 | 1200 |
ƽ�ⳣ�� | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
��ش��������⣺
(1)�÷�Ӧƽ�ⳣ������ʽΪK=_______����H=_______0��ѡ�>������<����=������
(2)830��ʱ����һ��5L���ܱ������г���0.40mol��A��0.60mol��B����Ӧ��6minʱ�ﵽƽ��״̬��
�ٸö�ʱ����A��ƽ����Ӧ����v(A)=__________���ﵽƽ��ʱB��ת����Ϊ_________��
��������ʱ������ϵ�����ͷ�48kJ��������д���÷�Ӧ���Ȼ�ѧ����ʽ��_________��
�۴�ʱ����ܱ������г���1mol�����ƽ��ʱA��ת����_______��ѡ���������С���������䡱����
(3)�жϸ÷�Ӧ�ﵽƽ�������Ϊ_________������ȷѡ�����ĸ����
a��ѹǿ����ʱ��ı� b��������ܶȲ���ʱ��ı�
c��c(A)����ʱ��ı� d����λʱ��������C��D�����ʵ������
e����λʱ��������amolA��ͬʱ������amolB
(4)1200��ʱ��ӦC(g)+D(g)![]() A(g)+B(g)��ƽ�ⳣ����ֵΪ_________��
A(g)+B(g)��ƽ�ⳣ����ֵΪ_________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com