
| A. | 中子数为35的氯原子:${\;}_{17}^{35}$Cl | B. | 氯化铵的电子式: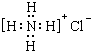 | ||
| C. | 硫化氢的结构式:H-S-H | D. | 二氧化硅的分子式:SiO2 |
分析 A.氯原子的质子数为17,质量数=质子数+中子数,元素符号的左上角为质量数、左下角为质子数;
B.氯离子为阴离子,电子式中氯离子应该标出最外层电子;
C.用短线代替所有的共用电子对即为结构式;
D.二氧化硅为原子晶体,不存在二氧化硅分子.
解答 解:A.中子数为35的氯原子的质量数=35+17=52,该原子正确的表示方法为:5217Cl,故A错误;
B.氯化铵为离子化合物,铵根离子和氯离子都需要标出所带电荷及最外层电子,正确正确的电子为 ,故B错误;
,故B错误;
C.硫化氢为共价化合物,分子中含有2个H-S键,其结构式为:H-S-H,故C正确;
D.SiO2为二氧化硅的化学式,不是分子式,故D错误;
故选C.
点评 本题考查了常见化学用语的表示方法,题目难度中等,涉及电子式、元素符号、结构式、分子式与化学式等知识,明确常见化学用语的书写原则为解答关键,试题培养了学生的规范答题能力.


科目:高中化学 来源: 题型:选择题
| A. | 分离碘单质和四氯化碳的混合物需要烧杯、玻璃棒和漏斗 | |
| B. | 用湿润的pH试纸测定溶液的pH一定会产生误差 | |
| C. | 实验室可以向浓硫酸中滴加浓盐酸制取少量氯化氢 | |
| D. | 用浓氨水可以除去试管内壁银镜 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
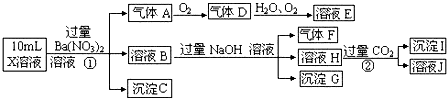
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
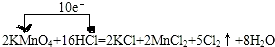 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所得的分散系属于悬浊液 | |
| B. | 该分散系能产生丁达尔效应 | |
| C. | 所得的分散系中水是分散质 | |
| D. | 将所得分散系过滤,在滤纸上能得到分散质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
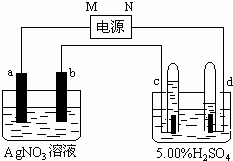 如图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极.通电一段时间后,在c、d两极上共收集到336mL(标准状态)气体.请回答下列问题.
如图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极.通电一段时间后,在c、d两极上共收集到336mL(标准状态)气体.请回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,8 g CH4含有4NA个氢原子 | |
| B. | 2gD216O中含有的质子数为2NA个 | |
| C. | 1 mol Cu与足量FeCl3溶液反应,转移2NA个电子 | |
| D. | 通常状况下,2.24 L氮气含有0.1NA个N2分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com