
【题目】高炉炼铁中发生的基本反应之一如下:FeO(s)+CO(g)Fe(s)+CO2(g)(正反应是吸热反应),其平衡常数可表示为K= ![]() ,已知1100℃时K=0.263
,已知1100℃时K=0.263
(1)温度升高,化学平衡移动后达到新的平衡,高炉内CO2和CO的体积比值;平衡常数K值(选填“增大”“减小”或“不变”)
(2)1100℃时测得高炉中c(CO2)=0.025molL﹣1、c(CO)=0.1molL﹣1 , 在这种情况下,该反应是否处于化学平衡状态(选填“是”或“否”),此时,化学反应速率是v(正)v(逆)(选填“大于”“小于”或“等于”),其原因是 .
【答案】
(1)增大;增大
(2)否;大于;Qc= ![]() =0.25<0.263,因为温度不变,K不变,为增大K平衡应向正向移动,所以v(正)>v(逆)
=0.25<0.263,因为温度不变,K不变,为增大K平衡应向正向移动,所以v(正)>v(逆)
【解析】解:(1)可逆反应FeO(s)+CO (g)Fe(s)+CO2(g)的平衡常数表达式k= ![]() ;该反应正反应是放热反应,温度降低平衡向正反应方向移动,CO2的物质的量增大、CO的物质的量减小,故到达新平衡是CO2与CO的体积之比增大,其平衡常数增大,所以答案是:增大;增大;(2)此时浓度商Qc=
;该反应正反应是放热反应,温度降低平衡向正反应方向移动,CO2的物质的量增大、CO的物质的量减小,故到达新平衡是CO2与CO的体积之比增大,其平衡常数增大,所以答案是:增大;增大;(2)此时浓度商Qc= ![]() =0.25,小于平衡常数0.263,故反应不是平衡状态,反应向正反应方向进行,v(正)>v(逆),所以答案是:否;大于;Qc=
=0.25,小于平衡常数0.263,故反应不是平衡状态,反应向正反应方向进行,v(正)>v(逆),所以答案是:否;大于;Qc= ![]() =0.25<0.263,因为温度不变,K不变,为增大K平衡应向正向移动,所以v(正)>v(逆).
=0.25<0.263,因为温度不变,K不变,为增大K平衡应向正向移动,所以v(正)>v(逆).
【考点精析】解答此题的关键在于理解化学平衡状态本质及特征的相关知识,掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效).


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】可逆反应:2NO2 ![]() 2NO+O2在体积固定的密闭容器中,达到平衡状态的标志是( ) ①单位时间内生成n mol O2的同时生成2n mol NO2
2NO+O2在体积固定的密闭容器中,达到平衡状态的标志是( ) ①单位时间内生成n mol O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时生成2n mol NO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态
⑦混合气体的平均相对分子质量不再改变的状态.
A.①④⑥⑦
B.②③⑤⑦
C.①③④⑤
D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的锌与100mL 18.5mol/L H2SO4充分反应后,锌完全溶解,同时生成气体A 22.4L(标准状况).将反应后的溶液稀释至1L,测得溶液的pH=1,则下列叙述中错误的是( )
A.气体A为SO2和H2的混合物
B.反应中共消耗Zn 65g
C.气体A中SO2和H2的体积比为1:4
D.反应中共转移电子2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是( )
A.电负性的大小顺序为Cl>S>P
B.由于NO3﹣和SO3互为等电子体,所以可以推断NO3﹣的空间构型为平面三角形
C.根据晶格能的大小可以判断MgCl2的熔点比CaCl2高
D.液态HF的沸点比液态HCl的沸点高是因为氢氟键的键能比氢氯键的键能大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列反应的离子方程式
(1)碳酸钙与稀盐酸混合 ______________________________。
(2)铝与氢氧化钠溶液反应 ______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷是地壳中含量较为丰富的非金属元素,主要以难溶于水的磷酸盐如Ca3(PO4)2等形式存在.它的单质和化合物在工农业生产中有着重要的应用.Ⅰ.白磷(P4)可由Ca3(PO4)2、焦炭和SiO2在电炉中高温(约1550℃)下通过下面两个反应共熔得到.
①2Ca3(PO4)2(s)+5C(s)=6CaO(s)+P4(s)+5CO2(g)△H1=+Ql kJmol﹣1
②CaO(s)+SiO2(s)=CaSiO3(s)△H2=﹣Q2 kJmol﹣1
(1)写出电炉中发生总反应的热化学方程式Ⅱ.三氯氧磷(化学式:POCl3)常用作半导体掺杂剂及光导纤维原料.氯化水解法生产三氯氧磷的流程如图甲: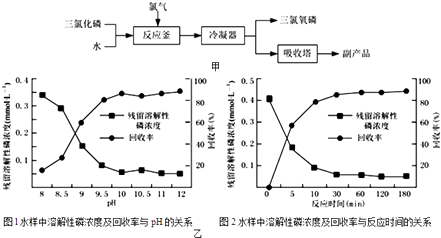
(2)写出氯化水解法生产三氯氧磷的化学方程式为 . 氯化水解法生产三氯氧磷会产生含磷(主要为H3PO4、H3PO3等)废水.在废水中先加入适量漂1白粉,再加入生石灰调节pH将磷元素转化为磷酸的钙盐沉淀并回收.
(3)POCl3、H3PO4、H3PO3中磷元素的化合价分别为、、 .
(4)在沉淀前先加入适量漂白粉的作用是 .
(5)Ⅲ.如图乙是不同条件对磷的沉淀回收率的影响图象.处理该厂废水最合适的工艺条件为(选填字母).a.调节pH=9 b.调节pH=10 c.反应时间30min d.反应时间120min
(6)己知磷酸是三元酸,其各级电离常数如下:K1=7.1×10﹣3 K2=6.3×l0﹣8K3=4.2×10﹣13 , 则0.1mol/L的NaH2PO4溶液的pH7(填>,=,<).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑨九种元素,填写下列空白:
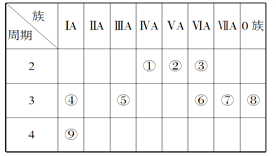
(1)在这些元素中,化学性质最不活泼的是________(填元素符号),②位于元素周期表的第____纵行。
(2)在最高价氧化物的水化物中,碱性最强的化合物的电子式是___________。
(3)④的单质比⑨的单质熔点_______(填“高”或“低”),④⑤⑥⑦的简单离子半径由小到大为___________________。(用序号表示)
(4)①与⑦形成的某种化合物经常用作萃取剂,其结构式为__________,该化合物属于________(填“共价”或“离子”)化合物。④与③形成的淡黄色的固体的阴、阳离子的个数比为_______。
(5)元素③与元素⑥相比,能证明这两种元素非金属性强弱的事实是_______(填选项序号)。
A.常温下③的单质和⑥的单质状态不同
B.③的简单氢化物比⑥的简单氢化物稳定
C.③的简单氢化物的沸点比⑥的简单氢化物的沸点高
D.③的单质能与⑥的简单氢化物反应生成⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com