
 已知砷(As)元素的原子结构示意图为:
已知砷(As)元素的原子结构示意图为:
分析 (1)电子层等于周期序数,最外层电子数等于最高正化合价;
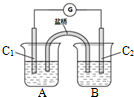
(2)①加盐酸时,可逆反应AsO43-+2I-+2H+?AsO33-+I2+H2O,氢离子的浓度变大,平衡正向移动,A中碘离子发生氧化反应为负极,所以C1为负极;
②该电极反应式为AsO33-+I2+2OH-?AsO43-+2I-+H2O;
(3)根据题目信息砒霜、锌粉和盐酸为反应物,生成物之一为AsH3,根据质量守恒定律可写出反应的化学方程式.
解答 解:(1)电子层等于周期序数,4个电子层,所以周期数为:四,最外层有5个电子,所以最高正价为+5,故答案为:四;+5;
(2)①加盐酸时,可逆反应AsO43-+2I-+2H+?AsO33-+I2+H2O,氢离子的浓度变大,平衡正向移动,A中碘离子发生氧化反应为负极,所以C1为负极,
故答案为:右(正反应); 负;
②加NaOH溶液时平衡逆向移动,该过程中C2棒为负极失电子发生氧化反应,电极反应为AsO33-+2OH--2e-=AsO43-+H2O,
故答案为:AsO33-+2OH--2e-=AsO43-+H2O;
(3)根据题目信息砒霜、锌粉和盐酸为反应物,生成物之一为AsH3,根据质量守恒定律可写出反应的化学方程式As2O3+12HCl+6Zn=6ZnCl2+2AsH3↑+3H2O,
故答案为:As2O3+6Zn+12HCl=2AsH3↑+6ZnCl2+3H2O.
点评 本题考查原子结构确定元素在周期表中的位置,结合电化学考查平衡移动,根据题意书写化学方程式,学生要在读懂题目条件的情况下解题,考查学生筛选信息的能力,比较容易.


科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L的水中含有0.5NA个水分子 | |
| B. | 含有1molHCl的盐酸中离子总数为NA个 | |
| C. | 1molO2和H2的混合气体中含有NA个分子 | |
| D. | 1mol大米中含有NA个大米粒子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶解度:MgCO3>Mg(OH)2 | B. | 金属性:Mg<K | ||
| C. | 还原性:H2S<SiH4 | D. | 稳定性:HF>PH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
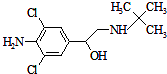 克伦特罗是“瘦肉精”的一种,其结构如图所示,关于该有机物的说法正确的是( )
克伦特罗是“瘦肉精”的一种,其结构如图所示,关于该有机物的说法正确的是( )| A. | 该有机物的分子式为C12H18Cl2N2O | |
| B. | 1mol该有机物中含有3mol碳碳双键 | |
| C. | 该有机物中至少有15个原子在同一平面内 | |
| D. | 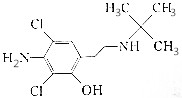 和该有机物互为同分异构体 和该有机物互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 构成单质的分子中一定含有共价键 | |
| B. | 由非金属元素组成的化合物可能是离子化合物 | |
| C. | 非极性键只存在单质分子里 | |
| D. | 不同元素组成的多原子分子里的化学键一定是极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 | B. | 2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$C+2MgO | ||
| C. | CuO+2HCl═CuCl2+H2O | D. | S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A>B>C | B. | B>C>A | C. | B>A>C | D. | C>A>B |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com