
| ||
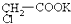 水溶液,并加热电解后的水溶液,则下列说法中合理的是( )
水溶液,并加热电解后的水溶液,则下列说法中合理的是( )| A、CO2气体在阴极放出 |
| B、加热后有不溶于水的油状物生成 |
| C、混合液蒸干后得到的固体物质是KOH |
| D、混合液蒸干后得到的固体物质是KCl |
| 电解 |
| △ |
| △ |


科目:高中化学 来源: 题型:
| A、室内着火被困,立即用湿毛巾堵住口鼻,匍匐前进,寻找安全出口 |
| B、发现有人煤气中毒,立即关闭阀门,将中毒人员转移到空气清新的地方 |
| C、浓碱溅到皮肤上,立即涂抹稀硫酸 |
| D、误服食品袋中的干燥剂(生石灰),立即喝食醋 |
查看答案和解析>>
科目:高中化学 来源: 题型:
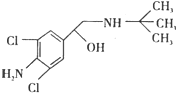 去年,某地区约 300 多人,因食用“瘦肉精”喂养的猪肉而中毒,己知瘦肉精的结构如如图,则它可能发生的化学反应有:①酯化反应 ②取代反应 ③氧化反应 ④消去反应( )
去年,某地区约 300 多人,因食用“瘦肉精”喂养的猪肉而中毒,己知瘦肉精的结构如如图,则它可能发生的化学反应有:①酯化反应 ②取代反应 ③氧化反应 ④消去反应( )| A、②④ | B、②③ |
| C、①②③ | D、①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将CO2通入BaCl2溶液中至饱和,无沉淀产生;再通入SO2,产生沉淀 |
| B、在稀硫酸中加入铜粉,铜粉不溶解;再加入Cu(NO3)2固体,铜粉仍不溶解 |
| C、向AlCl3溶液中滴加氨水,产生白色沉淀;再加入NaHSO4溶液,沉淀消失 |
| D、除去FeCl2中少量的FeBr2,加入适量氯水;再加四氯化碳萃取分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=0的溶液中:Na+、K+、SO32-、MnO4- |
| B、某无色中性溶液中:Cl-、NO3-、Al3+、K+ |
| C、pH>12的溶液中:Na+、K+、SO42-、ClO- |
| D、加入Al粉能产生H2的溶液中:Na+、Cu2+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=9的氨水溶液稀释1000倍 |
| B、pH=9的烧碱溶液稀释1000倍 |
| C、pH=5的盐酸溶液稀释1000倍 |
| D、pH=5的氯化铵溶液稀释1000倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、4M mol |
| B、10M mol |
| C、10 M/3 mol |
| D、2 M/3 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、化石能源物质内部贮存着大量的能量 |
| B、吸热反应是由于反应物总能量低于生成物总能量,因而没有利用价值 |
| C、由石墨制金刚石是吸热反应,故石墨能量比金刚石能量低 |
| D、化学物质中的化学能可以在一定条件下转化为热能、机械能、光能、电能为人类所利用 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com