
(共14分)实现 “节能减排” 和“低碳经济”的一项重要课题就是如何将CO2转化为可利用的资源。目前工业上有一种方法是用CO2来生产燃料甲醇。一定条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ·mol-1)的变化:
CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ·mol-1)的变化: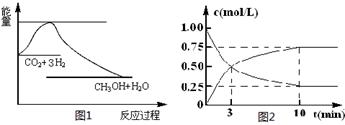
(1)关于该反应的下列说法中,正确的是____________(填字母)。
A.DH>0,DS>0 B.DH>0,DS<0 C.DH<0,DS<0 D.DH<0,DS>0
(2)为探究反应原理,现进行如下实验,在体积为l L的密闭容器中,充入l mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示。
CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示。
①从反应开始到平衡,CH3OH的平均反应速率v(CH3OH) = mol·(L·min)-1;
H2的转化率w(H2) =
②该反应的平衡常数表达式K=
③下列措施中能使化学平衡向正反应方向移动的是 (填字母)。
A.升高温度 B.将CH3OH(g)及时液化抽出
C.选择高效催化剂 D.再充入l molCO2和3 molH2
(3)25℃,1.01×105Pa时,16g液态甲醇完全燃烧,当恢复到原状态时,放出363.3kJ的热量,写出表示CH3OH燃烧热的热化学方程式:
(4)选用合适的合金为电极,以氢氧化钠、甲醇、水、氧气为原料,可以制成一种以甲醇为原料的燃料电池,此电池的负极电极反应式
科目:高中化学 来源: 题型:
(共14分)实现 “节能减排” 和“低碳经济”的一项重要课题就是如何将CO2转化为可利用的资源。目前工业上有一种方法是用CO2来生产燃料甲醇。一定条件下发生反应:
CO2(g)+3H2(g)CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ·mol-1)的变化:
(1)关于该反应的下列说法中,正确的是____________(填字母)。
A.DH>0,DS>0 B.DH>0,DS<0 C.DH<0,DS<0 D.DH<0,DS>0
(2)为探究反应原理,现进行如下实验,在体积为l L的密闭容器中,充入l mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示。
①从反应开始到平衡,CH3OH的平均反应速率v(CH3OH) = mol·(L·min)-1;
H2的转化率w(H2)=
②该反应的平衡常数表达式K=
③下列措施中能使化学平衡向正反应方向移动的是 (填字母)。
A.升高温度 B.将CH3OH(g)及时液化抽出
C.选择高效催化剂 D.再充入l molCO2和3 molH2
(3)25℃,1.01×105Pa时,16g 液态甲醇完全燃烧,当恢复到原状态时,放出363.3kJ的热量,写出表示CH3OH燃烧热的热化学方程式:
(4)选用合适的合金为电极,以氢氧化钠、甲醇、水、氧气为原料,可以制成一种以甲醇为原料的燃料电池,此电池的负极电极反应式
查看答案和解析>>
科目:高中化学 来源: 题型:
(共14分)Ⅰ.化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求。某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1 mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如下图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体滴加一滴浓盐酸,再立即用表面皿盖好。(已知2KMnO4+16HCl(浓) 2KCl +2MnCl2 +5Cl2↑+8H2O)?
(1)e处反应的离子方程式为 。
该反应中氧化剂和还原剂的物质的量之比为 。
(2)b处的实验现象: 。?d处的实验现象: 。(3)c处反应的化学方程式为 。
Ⅱ.混合物A由碳酸钠和碳酸氢钠组成。现有两包质量相等的混合物A:
(1)若向其中一包加入100mL 3mol/L的Ba(OH)2溶液(过量),使HCO3-、CO32-全部变为沉淀,过滤后,再向滤液中加入200mL 2mol/L的稀盐酸,溶液恰好呈中性。
①写出下列反应的离子方程式
碳酸氢钠与过量氢氧化钡的反应: ;
②混合物A中NaHCO3的质量为 g。
(2)若向另一包中先加50mL8mol/L的HCl溶液,使HCO3-、CO32-全部变为CO2后,再加50mL2mol/L的Ba(OH)2溶液,混合后的溶液pH=14(混合后溶液体积变化忽略不计、在常温下)。混合物A中Na2CO3的质量为_______________g。
查看答案和解析>>
科目:高中化学 来源:2010年湖北襄樊四校高三上学期期中联考化学卷 题型:填空题
(共14分)Ⅰ.化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求。某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1 mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如下图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体滴加一滴浓盐酸,再立即用表面皿盖好。(已知2KMnO4+16HCl(浓)  2KCl +2MnCl2 +5Cl2↑+8H2O)?
2KCl +2MnCl2 +5Cl2↑+8H2O)?







 (1)e处反应的离子方程式为 。
(1)e处反应的离子方程式为 。
 该反应中氧化剂和还原剂的物质的量之比为 。
该反应中氧化剂和还原剂的物质的量之比为 。
 (2)b处的实验现象: 。?
(2)b处的实验现象: 。?
 d处的实验现象: 。
d处的实验现象: 。
 (3)c处反应的化学方程式为 。
(3)c处反应的化学方程式为 。

Ⅱ.混合物A由碳酸钠和碳酸氢钠组成。现有两包质量相等的混合物A:
(1)若向其中一包加入100mL 3mol/L的Ba(OH)2溶液(过量),使HCO3-、CO32-全部变为沉淀,过滤后,再向滤液中加入200mL 2mol/L的稀盐酸,溶液恰好呈中性。
①写出下列反应的离子方程式
碳酸氢钠与过量氢氧化钡的反应: ;
②混合物A中NaHCO3的质量为 g。 (2)若向另一包中先加50mL8mol/L的HCl溶液,使HCO3-、CO32-全部变为CO2后,再加50mL2mol/L的 Ba(OH)2溶液,混合后的溶液pH=14(混合后溶液体积变化忽略不计、在常温下)。混合物A中Na2CO3的质量为_______________g。
(2)若向另一包中先加50mL8mol/L的HCl溶液,使HCO3-、CO32-全部变为CO2后,再加50mL2mol/L的 Ba(OH)2溶液,混合后的溶液pH=14(混合后溶液体积变化忽略不计、在常温下)。混合物A中Na2CO3的质量为_______________g。
查看答案和解析>>
科目:高中化学 来源:2013届年天津市等三校高二上学期期末联考化学试卷 题型:填空题
(共14分)实现 “节能减排” 和“低碳经济”的一项重要课题就是如何将CO2转化为可利用的资源。目前工业上有一种方法是用CO2来生产燃料甲醇。一定条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ·mol-1)的变化:
CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ·mol-1)的变化:
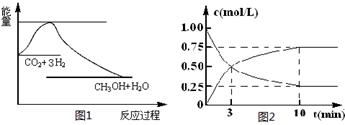
(1)关于该反应的下列说法中,正确的是____________(填字母)。
A.DH>0,DS>0 B.DH>0,DS<0 C.DH<0,DS<0 D.DH<0,DS>0
(2)为探究反应原理,现进行如下实验,在体积为l L的密闭容器中,充入l mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示。
CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示。
①从反应开始到平衡,CH3OH的平均反应速率v(CH3OH) = mol·(L·min)-1;
H2的转化率w(H2) =
②该反应的平衡常数表达式K=
③下列措施中能使化学平衡向正反应方向移动的是 (填字母)。
A.升高温度 B.将CH3OH(g)及时液化抽出
C.选择高效催化剂 D.再充入l molCO2和3 molH2
(3)25℃,1.01×105Pa时,16g 液态甲醇完全燃烧,当恢复到原状态时,放出363.3kJ的热量,写出表示CH3OH燃烧热的热化学方程式:
(4)选用合适的合金为电极,以氢氧化钠、甲醇、水、氧气为原料,可以制成一种以甲醇为原料的燃料电池,此电池的负极电极反应式
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com