
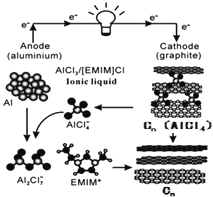
【题目】我国科学家成功研制出铝-石墨烯(![]() )可充电电池,电解质为阳离子(
)可充电电池,电解质为阳离子(![]() )与阴离子(
)与阴离子(![]() )组成的离子液体,该电池放电过程如右图所示。下列说法错误的是
)组成的离子液体,该电池放电过程如右图所示。下列说法错误的是
A.放电时负极的反应为:![]()
B.放电时石墨烯为正极,发生还原反应
C.充电时石墨烯与电源的正极相连
D.充电时的总反应为:![]()
【答案】A
【解析】
由示意图可知放电时铝为负极,被氧化生成Al2Cl7-,电极方程式为Al+7AlCl4--3e-═4Al2Cl7-,正极反应为3Cn[AlCl4]+3e-=3Cn+3AlCl4-,电解时阳极发生氧化反应,电极反应为Cn+AlCl4--e-═Cn[AlCl4],阴极发生还原反应,电极方程式为4Al2Cl7-+3e-=Al+7AlCl4-,据此分析解答。
A.放电时铝为负极,被氧化生成Al2Cl7-,发生氧化反应,电极反应式为Al+7AlCl4--3e-═4Al2Cl7-,故A错误;
B.放电时,石墨烯为正极,发生还原反应,电极反应为3Cn[AlCl4]+3e-=3Cn+3AlCl4-,故B正确;
C.放电时,石墨烯为正极,充电时,Cn为阳极,与电源的正极相连,故C正确;
D.充电时,阳极电极反应为Cn+AlCl4--e-═Cn[AlCl4],阴极电极方程式为4Al2Cl7-+3e-=Al+7AlCl4-,因此充电时的总反应为:3Cn+4Al2Cl7-═Al+4AlCl4-+3Cn[AlCl4],故D正确;
故选A。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列叙述正确的是
A.标准状况下,22.4 L乙酸中含有的碳碳单键总数为2NA
B.常温下,46 g NO2气体中所含有的分子数为NA
C.1 mol氖气中含有的原子总数为NA
D.0.1 L0.1 mol· L-1 MgCl2溶液中的Mg2+数目为0. 01NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是生产生活中的常见有机物的分子式、结构式、结构简式或名称有关说法正确的是
①![]() ②
②![]() ③
③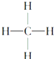 ④
④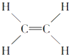 ⑤CH3CH2OH
⑤CH3CH2OH
⑥C6H12O6⑦CH3COOH ⑧硬脂酸甘油酯 ⑨蛋白质 ⑩聚乙烯
A. 能跟溴的四氯化碳溶液发生加成反应并使之褪色的有①②④⑩
B. 投入钠能产生H2的是⑤⑦⑧⑨
C. 属于高分子材料的是⑧⑨⑩
D. 含碳量最高、有毒、常温下为液体且点燃时有浓烟的是①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用有机物甲可制备环己二烯(![]() ),其反应路线如图所示:
),其反应路线如图所示:
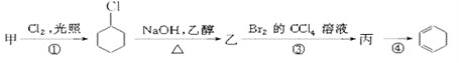
已知:RCH2CH2Br![]() RCH=CH2
RCH=CH2
下列有关判断正确的是( )
A.甲的化学名称是苯B.乙的结构简式为![]()
C.反应①为加成反应D.有机物丙既能发生加成反应,又能发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关.
(1)下列生活用品中,其主要材料属于天然纤维的是_________(填字母序号);
A.塑料保鲜薄 B.橡胶手套 C.棉布围裙
(2)我们常用的洗涤剂清洗餐具上的油污,这是因为洗涤剂具有_________的功能;
(3)食用水果、蔬菜主要补充人体所需的_________;
(4)国家禁止在面粉中添加增白剂过氧化钙CaO2,过氧化钙中氧元素的化合价为_______;
(5)农业上降低土壤酸性的是_________(填化学式);
(6)生活中要用到大量的钢铁,写出赤铁矿(主要成分Fe2O3)冶炼成铁的化学方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.氮和氮的化合物在国防、工农业生产和生活中都有极其广泛的用途。请回答下列问题:
(1)亚硝酰氯(结构式为![]() )是有机合成中的重要试剂,它可由
)是有机合成中的重要试剂,它可由![]() 和
和![]() 在常温常压条件下反应制得,反应方程式为:
在常温常压条件下反应制得,反应方程式为:![]() 。已知几种化学键的键能数据如表所示:
。已知几种化学键的键能数据如表所示:
化学键 |
|
|
|
|
键能 | 243 | 200 | 607 | 630 |
则![]()
![]() ________
________![]() 。
。
(2)在一个恒容密闭容器中充入![]() 和
和![]() 发生(1)中的反应,在温度分别为
发生(1)中的反应,在温度分别为![]() ℃、
℃、![]() ℃时测得
℃时测得![]() 的物质的量(单位:mol)与时间的关系如下表所示:
的物质的量(单位:mol)与时间的关系如下表所示:
t/min 温度 | 0 | 5 | 8 | 13 |
| 2 | 1.5 | 1.3 | 1.0 |
| 2 | 1.15 | 1.0 | 1.0 |
①![]() ________
________![]() (填“
(填“![]() ”“
”“![]() ”或“
”或“![]() ”)。
”)。
②温度为![]() 时,起始时容器内的压强为
时,起始时容器内的压强为![]() ,则该反应的平衡常数
,则该反应的平衡常数![]() ________(用平衡分压代替平衡浓度计算,分压
________(用平衡分压代替平衡浓度计算,分压![]() 总压
总压![]() 物质的量分数)(化为最简式)。
物质的量分数)(化为最简式)。
(3)近年来,地下水中的氮污染已成为世界性的环境问题。在金属![]() 、
、![]() 和依(
和依(![]() )的催化作用下,
)的催化作用下,![]() 可高效转化酸性溶液中的硝态氮(
可高效转化酸性溶液中的硝态氮(![]() ),其工作原理如图所示。
),其工作原理如图所示。
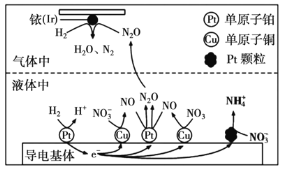
①![]() 表面发生反应的化学方程式为:________。
表面发生反应的化学方程式为:________。
②若导电基体上的![]() 颗粒增多,造成的后果是________。
颗粒增多,造成的后果是________。
Ⅱ.利用电化学原理,将![]() 、
、![]() 和熔融
和熔融![]() 制成燃料电池,模拟工业电解法精炼银,装置如下图所示。
制成燃料电池,模拟工业电解法精炼银,装置如下图所示。
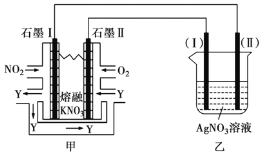
(4)①甲池工作时,![]() 转变成绿色硝化剂
转变成绿色硝化剂![]() ,可循环使用,则石墨Ⅱ附近发生的电极反应方程式为________。
,可循环使用,则石墨Ⅱ附近发生的电极反应方程式为________。
②若用10A的电流电解50min后,乙中阴极得到![]() ,则该电解池的电解效率为________%。(保留小数点后一位。通过一定电量时阴极上实际沉积的金属质量与通过相同电量时理论上应沉积的金属质量之比叫电解效率。法拉第常数为
,则该电解池的电解效率为________%。(保留小数点后一位。通过一定电量时阴极上实际沉积的金属质量与通过相同电量时理论上应沉积的金属质量之比叫电解效率。法拉第常数为![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酯类化合物与格氏试剂(![]() ,
,![]() 、Br、I)的反应是合成叔醇类化合物的重要方法,可用于制备含氧多官能团化合物。化合物F的合成路线如下,回答下列问题:
、Br、I)的反应是合成叔醇类化合物的重要方法,可用于制备含氧多官能团化合物。化合物F的合成路线如下,回答下列问题:
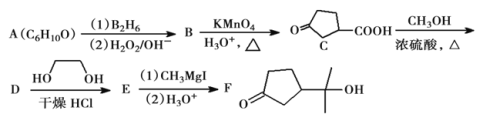
已知:①![]()
②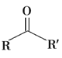
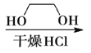
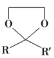
![]()
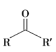
③![]()
![]()
![]()
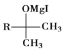
![]()
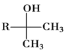
(1)A的结构简式为________;B中官能团的名称为________;![]() 的反应程式为________,其反应类型为________。
的反应程式为________,其反应类型为________。
(2)C与足量的![]() 反应后得到物质G,写出符合下列条件的G的同分异构体________(填结构简式,不考虑立体异构)。
反应后得到物质G,写出符合下列条件的G的同分异构体________(填结构简式,不考虑立体异构)。
①含有五元环结构;②能与![]() 溶液反应放出
溶液反应放出![]() 气体;
气体;
③![]() 与足量的钠反应,产生
与足量的钠反应,产生![]() 。
。
(3)碳原子上连有4个不同的原子或基团时,该碳称为手性碳。用“*”标出化合物F中的手性碳原子。__________
(4)写出以![]() 、格氏试剂和
、格氏试剂和![]() 为原料制备的合成
为原料制备的合成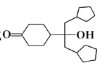 路线(其他试剂任选)。__________
路线(其他试剂任选)。__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的产物中,有的有同分异构体,有的没有同分异构体,其中一定不存在同分异构体的反应是
A.异戊二烯(![]() )与等物质的量的Br2发生加成反应
)与等物质的量的Br2发生加成反应
B.2氯丁烷与NaOH乙醇溶液共热发生消去HCl分子的反应
C.甲苯在一定条件下发生硝化反应生成一硝基甲苯的反应
D.邻羟基苯甲酸与NaHCO3溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知难溶电解质在水溶液中存在溶解平衡MmAn(s)![]() mMn+(aq)+nAm-(aq),Ksp=cm(Mn+)·cn(Am-)称为溶度积。
mMn+(aq)+nAm-(aq),Ksp=cm(Mn+)·cn(Am-)称为溶度积。
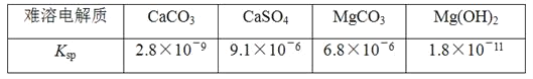
某学习小组欲探究CaSO4沉淀转化为CaCO3沉淀的可能性,查得如下资料(25℃):
他们的实验步骤如下:
①往100mL0.1mol·L-1的CaCl2溶液中加入0.1mol·L-1的Na2SO4溶液100mL立即有白色沉淀生成。
②向上述悬浊液中加入固体Na2CO33g,搅拌,静置后弃去上层清液。
③再加入蒸馏水搅拌,静置后再弃去上层清液。
④___________________________。
(1)由题中信息知Ksp越大,表示电解质的溶解度越__(填“大”或“小”)。
(2)写出第②步发生反应的化学方程式__。
(3)设计第③步的目的是什么__。
(4)请补充第④步操作及发生的现象__。
(5)请写出该转化在实际生活、生产中的一个应用__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com