
| A. | 成分为盐酸的洁厕灵与84消毒液混合使用易中毒:Cl-+ClO-+2H+=Cl2↑+H2O | |
| B. | Na2O2与H2O反应:2O22-+2H2O=4OH-+O2↑ | |
| C. | NaHSO4溶液中滴入少量Ba(OH)2:H++SO42-+Ba2++OH-=BaSO4↓+H2O | |
| D. | FeI2溶液中滴入过量溴水:2Fe2++2I-+2Br2=2Fe3++I2+4Br- |
分析 A.酸性条件下氯离子与次氯酸根离子反应生成氯气;
B.过氧化钠在离子方程式中不能拆开;
C.氢氧化钡少量,离子方程式按照氢氧化钡的化学式组成书写;
D.溴水过量,碘离子和亚铁离子都完全被氧化.
解答 解:A.成分为盐酸的洁厕灵与84消毒液混合后会生成氯气,易中毒,反应的离子方程式为:Cl-+ClO-+2H+=Cl2↑+H2O,故A正确;
B.Na2O2与H2O反应生成氢氧化钠和氧气,正确的离子方程式为:2Na2O2+2H2O=4OH-+O2↑,故B错误;
C.NaHSO4溶液中滴入少量Ba(OH)2,反应生成硫酸钠、硫酸钡沉淀和水,正确的离子方程式为:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,故C错误;
D.FeI2溶液中滴入过量溴水,离子方程式按照溴化亚铁的组成书写,正确的离子方程式为:2Fe2++4I-+3Br2=2Fe3++2I2+4Br-,故D错误;
故选A.
点评 本题考查了离子方程式的正误判断,为高考的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.


科目:高中化学 来源: 题型:选择题
| A. | 反应速率VB(正)=VC(逆) | B. | B、C物质的量之比保持不变 | ||
| C. | B的体积分数不变 | D. | 混合气体的密度保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去).则W、X不可能是( )
已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去).则W、X不可能是( )| 选项 | W | X |
| A | 稀硫酸 | Na[Al(OH)4]溶液 |
| B | 稀硝酸 | Fe |
| C | CO2 | Ca(OH)2溶液 |
| D | Cl2 | Fe |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
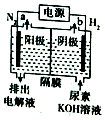 用如图所示的装置,采用廉价的镍催化剂,通过电化学方法,可在碱性环境中直接使尿素转化成纯氢,电极为惰性电极,隔膜仅阻止气体通过,下列相关叙述不正确的是( )
用如图所示的装置,采用廉价的镍催化剂,通过电化学方法,可在碱性环境中直接使尿素转化成纯氢,电极为惰性电极,隔膜仅阻止气体通过,下列相关叙述不正确的是( )| A. | 尿素由碳、氮、氧、氢四种元素组成的有机化合物 | |
| B. | 尿素在阳极被氧化,当生成1 mol N2时,转移电子为6 mol | |
| C. | a、b两处生成的气体体积比为1:3 | |
| D. | 假设电解过程中溶液体积不变,电解后排出液的pH比通入前大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 t℃时,AgBr在水中的沉淀溶解平衡曲线如图所示.又知t℃时AgCl的Ksp=4×10-10,下列说法不正确的是( )
t℃时,AgBr在水中的沉淀溶解平衡曲线如图所示.又知t℃时AgCl的Ksp=4×10-10,下列说法不正确的是( )| A. | 在t℃时,AgBr的Ksp为4.9×10-13 | |
| B. | 通过蒸发,可使溶液由a点变到c点 | |
| C. | 图中b点有AgBr沉淀析出 | |
| D. | 在t℃时,AgCl(s)+Br-(aq)?AgBr(s)+Cl-(aq)的平衡常数K≈816 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 向甲乙两个容积均为1L的恒容容器中,分别充入2moLA、2molB和1molA、1molB.相同条件下,发生下列反应:A(g)+B(g)?xC(g)△H<0.测得两容器中c(A)随时间t的变化如图所示:下列说法正确的是( )
向甲乙两个容积均为1L的恒容容器中,分别充入2moLA、2molB和1molA、1molB.相同条件下,发生下列反应:A(g)+B(g)?xC(g)△H<0.测得两容器中c(A)随时间t的变化如图所示:下列说法正确的是( )| A. | X可能等于2也可能等于3 | |
| B. | 向平衡后的乙容器中充入氦气可使c(A)增大 | |
| C. | 向甲容器中再充入2molA、2molB,则平衡时甲容器中0.78mol•L-1<c(A)<1.56mol•L-1 | |
| D. | 将乙容器单独升温可使乙容器内各物质的体积分数与甲容器内的相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H2、C2H4 | B. | C2H4、C3H6 | C. | C3H8、C3H6 | D. | C6H6、C7H8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
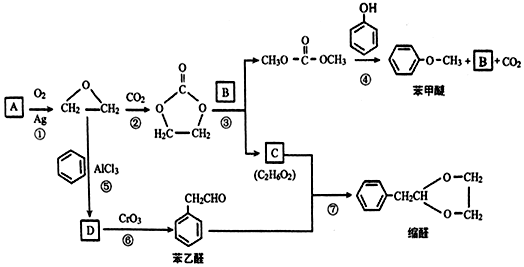
 .
.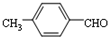 或
或
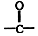 结构
结构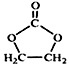 的合成路线,写出由2-氯丙烷和必要的无机试剂制备
的合成路线,写出由2-氯丙烷和必要的无机试剂制备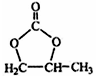 的合成流程图:
的合成流程图: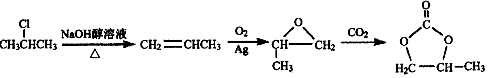
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com