
【题目】如图是实验室进行二氧化硫制备与性质实验的组合装置,部分固定装置未画出。下列有关说法正确的是

A. 关闭 K2,打开 K1,滴加硫酸,则装置 B 中每消耗 1molNa2O2,转移电子数为NA
B. 关闭 K1,打开 K2,试剂 X 是酸性 KMnO4 或 FeCl3 溶液,均可证明 SO2 有还原性
C. 为防止环境污染,装置C和E中的试剂均取用饱和的石灰水
D. 实验过程中体现了硫酸的酸性、吸水性、难挥发性、强氧化性
科目:高中化学 来源: 题型:
【题目】意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的气态N4分子,其分子结构如图所示。已知断裂1 mol N—N吸收167 kJ热量,生成1 mol N![]() N放出942 kJ热量。根据以上信息和数据,判断下列说法正确的是( )
N放出942 kJ热量。根据以上信息和数据,判断下列说法正确的是( )

A. N4属于一种新型的化合物 B. N4分子中存在非极性键
C. N4和N2是同分异构体 D. 1 mol N4转变成N2将吸收882 kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分离下列三组混合物依次采取的方法正确的是:①碳酸钙和氯化钙的溶液 ②植物油和氯化钠溶液 ③氯化钠溶液和鸡蛋清( )
A.渗析、蒸馏、萃取
B.分液、萃取、蒸馏
C.过滤、分液、聚沉
D.过滤、分液、渗析
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将BaCl2溶液加入某无色溶液后,生成白色沉淀,再加入稀HNO3 , 则沉淀不溶解,下列说法正确的是( )
A.一定存在Ag+
B.一定存在CO32﹣
C.一定存在SO42﹣
D.以上说法都不对
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国成功研制的一种新型可充放电 AGDIB 电池(铝-石墨双离子电池)采用石墨、铝锂合金作为电极材料,以常规锂盐和碳酸酯溶剂为电解液。电池反应为 CxPF6+LiyAl=Cx+LiPF6+Liy-1+Al。放电过程如图,下列说法正确的是
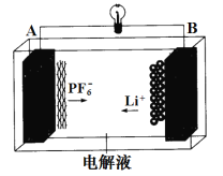
A. B为负极,放电时铝失电子
B. 电解液可以用常规锂盐和水代替
C. 充电时 A 电极反应式为 Cx + PF6- - e-= CxPF6
D. 废旧 AGDIB 电池进行“放电处理”时,若转移 1mol 电子,石墨电极上可回收 7gLi
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图片是立方烷(cunane)的球棍模型,下列有关说法不正确的是( )

A. 其一氯代物只有一种
B. 其二氯代物有三种同分异构体
C. 常温下为气体
D. 它与苯乙烯(C6H5—CH===CH2)互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,铁元素被氧化的是( )
A.FeS+2HCl=FeCl2+H2S↑
B.Fe+H2SO4=FeSO4+H2↑
C.FeO+2HCl=FeCl2+H2O
D.Fe2O3+3CO=2Fe+3CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)实验室中常用KClO3在MnO2催化下受热分解制取氧气,反应方程式为_____________。反应后,若想将混合物分离,可先加适量水,充分搅拌,_____________(填实验操作名称)可得MnO2,该实验操作所需的玻璃仪器为___________________________;将剩余部分通过____________(填实验操作名称)可得KCl。
(2)单质碘在水中溶解度较小,在CCl4中溶解度较大,为富集碘单质,可将碘水和CCl4加入到___________(填仪器名称)中,充分震荡后静置,下层溶液呈_________色,___________________________(填具体操作步骤),即可得到相对浓度较大的碘溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用质量分数为36.5%的浓盐酸(密度为1.16 g·cm-3)配制成1 mol·L-1的稀盐酸。现实验室仅需要这种盐酸220 mL,试回答下列问题:
(1)配制稀盐酸时,应选用容量为________mL的容量瓶。
(2)经计算需要________mL浓盐酸,在量取时宜选用下列量筒中的________。
A.5 mL B.10 mL C.25 mL D.50 mL
(3)在量取浓盐酸后,进行了下列操作:
①等稀释的盐酸的温度与室温一致后,沿玻璃棒注入250 mL容量瓶中。
②往容量瓶中小心加蒸馏水至液面离容量瓶刻度线1~2 cm时,改用胶头滴管加蒸馏水,使溶液的液面与瓶颈的刻度标线相切。
③在盛盐酸的烧杯中注入蒸馏水,并用玻璃棒搅动,使其混合均匀。
④用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶。
上述操作中,正确的顺序是(填序号)____________。
(4)在上述配制过程中,用刚刚洗涤洁净的量筒来量取浓盐酸,其配制的稀盐酸浓度是________(填“偏高”、“偏低”或“无影响”)。若未用蒸馏水洗涤烧杯内壁或未将洗涤液注入容量瓶,则配制的稀盐酸浓度是________(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com